Oxid fosforitý
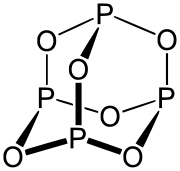
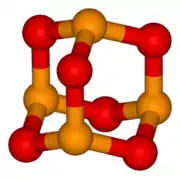
Oxid fosforitý tvorí dimérne molekuly P4O6. Je to biela, kryštalická, jedovatá a vosku podobná látka, ktorá sa ľahko roztápa. Je kyslého charakteru a s vodou vytvára roztok kyseliny fosforitej (je to jej anhydrid). Ľahko oxiduje.
| Oxid fosforitý | |||||||||||||||||||||||||||||||
 Oxid fosforitý | |||||||||||||||||||||||||||||||
 Oxid fosforitý | |||||||||||||||||||||||||||||||
| Všeobecné vlastnosti | |||||||||||||||||||||||||||||||
| Sumárny vzorec | P2O3 (P4O6, dimer) | ||||||||||||||||||||||||||||||
| Vzhľad | Biela kryštalická látka | ||||||||||||||||||||||||||||||
| Fyzikálne vlastnosti | |||||||||||||||||||||||||||||||
| Molárna hmotnosť | 219,891 g/mol | ||||||||||||||||||||||||||||||
| Teplota topenia | 23,8 °C | ||||||||||||||||||||||||||||||
| Teplota varu | 173,8 °C | ||||||||||||||||||||||||||||||
| Hustota | 2,135 g/cm³ (21 °C) | ||||||||||||||||||||||||||||||
| Rozpustnosť | v polárnych rozpúšťadlách: dietyléter v nepolárnych rozpúšťadlách: aromatické uhľovodíky sírouhlík | ||||||||||||||||||||||||||||||
| Termochemické vlastnosti | |||||||||||||||||||||||||||||||
| Entropia topenia | 64,1 J/g | ||||||||||||||||||||||||||||||
| Entropia varu | 197,4 J/g | ||||||||||||||||||||||||||||||
| Štandardná entropia | 346,9 J K−1 mol−1 | ||||||||||||||||||||||||||||||
| Merná tepelná kapacita | 0,662 J K−1 g−1 (25 °C, plyn) | ||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| Ďalšie informácie | |||||||||||||||||||||||||||||||
| Číslo CAS | 1314-24-5 | ||||||||||||||||||||||||||||||
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |||||||||||||||||||||||||||||||
Príprava
Oxid fosforitý sa vyrába spaľovaním fosforu za obmedzeného prístupu vzduchu:
- P4 + 3 O2 → P4O6
Chemické vlastnosti
Oxid fosforitý reaguje so studenou vodou na kyselinu fosforitú:
- P4O6 + 6 H2O → 4 H3PO3
Oxid fosforitý tiež reaguje s chlorovodíkom a produktom je kyselina fosforitá a chlorid fosforitý:
- P4O6 + 6 HCl → 2 H3PO3 + 2 PCl3
Podobné látky
- Sulfid fosforitý
- Oxid antimonitý
- Oxid arzenitý
- Oxid dusitý
- Oxid fosforečný
- Kyselina fosforitá
Literatúra
- VOHLÍDAL, Jiří; ŠTULÍK, Karel; JULÁK, Alois. Chemické a analytické tabuľky. 1. vyd. Praha : Grada Publishing, 1999. ISBN 80-7169-855-5.
Zdroj
Tento článok je čiastočný alebo úplný preklad článku Oxid fosforitý na českej Wikipédii.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.

