Kyselina siričitá
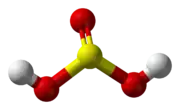
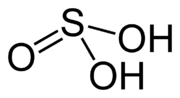
Kyselina siričitá, H2SO3 je stredne silná anorganická kyselina. Je prítomná je len v roztokoch, v ktorých vzniká rozpúšťaním oxidu siričitého:
- SO2 + H2O → H2SO3
| Kyselina siričitá | |||
 Kyselina siričitá | |||
 Kyselina siričitá | |||
| Všeobecné vlastnosti | |||
| Sumárny vzorec | H2SO3 | ||
| Fyzikálne vlastnosti | |||
| Molárna hmotnosť | 82,07 g/mol | ||
| Ďalšie informácie | |||
| Číslo CAS | 7782-99-2 | ||
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |||
Ak sa jej roztok zahrieva, dochádza spätne k rozkladu na vodu a oxid siričitý. Preto je možné oxid siričitý formálne označiť ako anhydrid kyseliny siričitej. Aj pri izbovej teplote dochádza k pomerne rýchlemu rozkladu roztokov kyseliny siričitej.
Kyselina siričitá disociuje vo vodnom roztoku v dvoch stupňoch:
- H2SO3 + H2O → H3O+ + HSO3−
- HSO3− → H3O+ + SO32−
Kyselina siričitá tvorí dva typy solí: siričitany a hydrogensiričitany. Siričitany sa na vzduchu pozvoľna zlučujú s kyslíkom a tým sa oxidujú na sírany. Kyselina siričitá a jej soli majú redukčné vlastnosti. Príkladom je reakcia s kyselinou dusitou:
- 2 HNO2 + H2SO3 → 2 NO + H2SO4 + H2O
Siričitany alkalických kovov sa zahrievaním rozkladajú a ich rozkladom vzniká síran a sulfid:
- 4 Na2SO3 → 3 Na2SO4 + Na2S
Siričitany kovov alkalických zemín sa však zahrievaním rozkladajú na oxid siričitý a príslušný oxid kovu:
- MgSO3 → MgO + SO2