Kyselina chlorečná
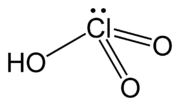
Kyselina chlorečná (HClO3) je oxokyselina chlóru a základný prekurzor solí chlorečnanov. Je to silná kyselina (pKa ≈ −1) a oxidačné činidlo. Pripravuje sa reakciou kyseliny sírovej s chlorečnanom bárnatým, produktami sú kyselina chlorečná a nerozpustný síran bárnatý:
- Ba(ClO3)2 + H2SO4 → 2 HClO3 + BaSO4
| Kyselina chlorečná | |||||||||||||||||||||||||
 Kyselina chlorečná | |||||||||||||||||||||||||
 Kyselina chlorečná | |||||||||||||||||||||||||
| Všeobecné vlastnosti | |||||||||||||||||||||||||
| Sumárny vzorec | HClO3 | ||||||||||||||||||||||||
| Vzhľad | Bezfarebná kvapalina[1] | ||||||||||||||||||||||||
| Fyzikálne vlastnosti | |||||||||||||||||||||||||
| Molárna hmotnosť | 84,45914 g mol−1 | ||||||||||||||||||||||||
| Teplota topenia | < −20 °C (heptahydrát) | ||||||||||||||||||||||||
| Teplota rozkladu | 40 °C (heptahydrát) | ||||||||||||||||||||||||
| Hustota | 1 g/ml | ||||||||||||||||||||||||
| Rozpustnosť | >40 g/100 ml (20 °C, vo vode) | ||||||||||||||||||||||||
| Termochemické vlastnosti | |||||||||||||||||||||||||
| Štandardná zlučovacia entalpia | −104 kJ/mol (vodný roztok) | ||||||||||||||||||||||||
| Štandardná entropia | 162 J K−1 mol−1 (vodný roztok) | ||||||||||||||||||||||||
| Štandardná Gibbsová energia | −8,04 kJ/mol (vodný roztok) | ||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Ďalšie informácie | |||||||||||||||||||||||||
| Číslo CAS | 7790-93-4 | ||||||||||||||||||||||||
| EINECS číslo | 232-233-0 | ||||||||||||||||||||||||
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |||||||||||||||||||||||||
Inou metódou je zahrievanie kyseliny chlórnej, pri ktorom vznikajú kyselina chlorečná a chlorovodíková:
- 3 HClO → HClO3 + 2 HCl
Kyselina chlorečná je v chladných roztokoch stabilná do koncentrácie približne 30 %, roztoky do 40 % je možné pripravovať opatrným odparovaním pri zníženom tlaku. Nad túto koncentráciu, a tiež pri zahrievaní, sa roztoky kyseliny chlorečnej rozkladajú za vzniku celej škály produktov, napríklad:
Rozklad je riadený kinetickými faktormi. Kyselina chlorečná nie je termodynamicky stabilná, vzhľadom na disproporcionáciu.
Referencie
- Helmut Sitzmann, in: Römpp Online - Version 3.5, 2009, Georg Thieme Verlag, Stuttgart.
- Nils Wiberg, Egon Wiberg, Arnold Fr. Holleman. Lehrbuch der Anorganischen Chemie. Berlin : [s.n.], 2007. S. 102.
Zdroj
Tento článok je čiastočný alebo úplný preklad článku Chloric acid na anglickej Wikipédii.


