Brachyterapia
Brachyterapia (z gréckeho brachys – blízko, zblízka) označovaná aj ako vnútorné ožarovanie alebo staršie curieterapia je forma rádioterapie, pri ktorej sa zdroj ionizujúceho žiarenia umiestňuje do blízkosti miesta, ktoré sa lieči (do blízkosti nádoru). Brachyterapia sa väčšinou používa v liečbe zhubných nádorov krčka maternice, prostaty, prsníka, kože, ale môže byť použitá aj pri zhubných nádoroch v iných lokalitách. Požíva sa samostatne ale aj v kombinácii s inými typmi liečby (externá rádioterapia, chirurgia, chemoterapia).
Na rozdiel od externej rádioterapie, kde je zdroj žiarenia mimo tela pacienta a ožaruje nádor z väčšej vzdialenosti (približne 100 cm), princíp brachyterapie spočíva v presnom zavedení malého zdroja žiarenia priamo do miesta výskytu nádorových buniek, ktorý ho ožaruje z krátkej vzdialenosti. Zdroj žiarenia je pevne uzavretý v kapsule (obale), ktorá dovoľuje žiareniu cez tento obal preniknúť, ale zabraňuje uvoľneniu rádioaktívneho materiálu do tela pacienta. Kapsula s rádioaktívnym materiálom je v niektorých prípadoch po ožiarení z tela odstránená, v niektorých v tele pacienta ostáva.
Hlavnou výhodou brachyterapie je, že sa ožaruje len veľmi obmedzený objem tkaniva v okolí zavedených zdrojov žiarenia, čo umožňuje výrazne redukovať nežiaduce ožiarenie zdravých tkanív v okolí nádorového ložiska. Navyše pri pohybe pacienta samotného, alebo pohybe tumoru v tele pacienta ostáva poloha zdrojov žiarenia vzhľadom na ožarovanú oblasť v rovnakej polohe. Pri brachyterapii preto môžu byť použité vyššie dávky žiarenia pri porovnaní s vonkajším ožiarením, samozrejme s ohľadom na okolité zdravé tkanivá.
Liečba brachyterapiou trvá väčšinou kratšie v porovnaní s inými metódami ožarovania. Kratší čas trvania liečby a vyššia dávka znižuje pravdepodobnosť ďalšieho delenia nádorových buniek medzi jednotlivými frakciami rádioterapie. Pacienti liečení brachyterapiou vyžadujú menej časté návštevy u lekára v porovnaní v externou rádioterapiou a často môže byť táto liečba realizovaná ambulantnou formou.
Brachyterapia predstavuje efektívnu možnosť liečby pri mnohých zhubných nádoroch. Liečebné výsledky opakovane potvrdili, že pri mnohých ochoreniach je miera vyliečenia ochorenia použitím brachyterapie porovnateľná s externou rádioterapiou a chirurgiou. Navyše brachyterapia predstavuje liečbu s menším rizikom nežiaducich účinkov.
Dejiny
História brachyterapie sa datuje od roku 1901 (krátko po objavení rádioaktivity Bequerelom), kedy Pierre Currie dal podnet Henri-Alexandre Danlosovi, že by bolo možné vložiť rádioaktívny zdroj do blízkosti nádoru. Následne pozorovali, že po aplikácii rádioaktívneho žiarenia sa nádor zmenšil. Nezávisle od tohto objavu, uvažoval nad využitím rádioaktivity v liečbe nádorov aj Alexander Graham Bell. Začiatkom dvadsiateho storočia boli dané základy modernej brachyterapie v Curie inštitúte v Paríži a v St. Luke's and Memorial Hospital v New Yorku. Po počiatočnom záujme o brachyterapiu v Európe a USA nastal v strede dvadsiateho storočia útlm pre ťažkosti s radiačnou ochranou pracovníkov (využívanie manuálneho afterloadingu).
Zavedenie automatického afterloadingu v 50. a 60. rokoch dvadsiateho storočia a nových zdrojov žiarenia redukoval možnosť nežiaduceho ožiarenia personálu a pacientov. Tento prístup spolu s novými možnosťami 3D zobrazovacích metód, novým pohľadom na plánovanie liečby a novou prístrojovou technikou (HDR prístroje) zabezpečili, že brachyterapia je dnes bezpečná a efektívna metóda využívaná v liečbe mnohých zhubných nádorov.
Typy brachyterapie
Brachyterapiu možno deliť podľa viacerých kritérií:
- podľa techniky zavedenia aplikátorov
- podľa príkonu rádioaktívnych zdrojov
- podľa dĺžky trvania aplikácie
Techniky brachyterapie
Podľa techniky zavedenia sa brachyterapia rozdeľuje na intersticiálnu a povrchovú.
- Pri intersticiálnej brachyterapii sú zdroje žiarenia zavádzané priamo do postihnutého tkaniva (napr. pri nádore prostaty alebo prsníka) prostredníctvom vpichov
- Pri povrchovej brachyterapii sú zdroje žiarenia umiestnené do úzkej vzdialenosti k postihnutému tkanivu. Môže to byť do telesných dutín (endokavitárna aplikácia – krčok maternice, maternica, vagína), do dutých orgánov (endoluminálna aplikácia – priedušnica, pažerák), na povrch tela (superficiálna aplikácia – koža). Pri aplikácii do ciev ide o intravaskulárnu aplikáciu.
Príkon brachyterapie
Podľa príkonu (úrovne intenzity žiarenia, ktoré je aplikované) sa brachyterapia delí na:
- LDR (brachyterapia s nízkym dávkovým príkonom) – zdroj žiarenia emituje nízku intenzitu žiarenia (menej ako 2 Gy za hodinu). LDR brachyterapia sa využíva najčastejšie pri liečbe nádorov prostaty.
- MDR (brachyterapia so stredným dávkovým príkonom) – dávkový príkon v rozmedzí 2 – 12 Gy za hodinu
- HDR (brachyterapia s vysokým dávkovým príkonom) – dávkový príkon je vyšší ako 12 Gy za hodinu. HDR brachyterapia sa dnes najčastejšie využíva pri liečbe karcinómov krčka maternice, pažeráku, pľúc, prsníka a prostaty.
- PDR (pulzná brachyterapia) – predstavuje brachyterapiu, pri ktorej sa liečba aplikuje v krátkych pulzoch (typicky každú hodinu) a tým napodobňuje výhody LDR, čo sa týka neskorej toxicity. Typickou oblasťou, kde sa využíva PDR brachyterapia sú nádory hlavy a krku a gynekologické nádory.
Trvanie brachyterapie
Podľa trvania aplikácie sa táto delí na dočasnú a permanentnú.
- Dočasná aplikácia – pri dočasnej brachyterapii sa do tela pacienta zavádza zdroj žiarenia len na nevyhnutnú dobu (minúty, desiatky minút až hodiny) a následne je z tela pacienta extrahovaný. Dĺžka pobytu zdroja žiarenia v pacientovi závisí od mnohých faktorov: veľkosti aplikácie, typu aplikácie, dávkového príkonu použitého žiarenia. Pri použití LDR a PDR brachyterapie je trvanie liečby niekoľko desiatok hodín, pri použití HDR brachyterapie ide o minúty až desiatky minút.
- Permanentná aplikácia – pri permanentnej brachyterapii sa do pacientovho tela zavádzajú malé LDR rádioaktívne zrná (približne ako zrnko ryže) s nízkym dávkovým príkonom. Aktivita takýchto zŕn postupne klesá až sa po čase stane nemerateľnou. Neaktívne zrná ostávajú v pacientovom tele. Najčastejšie sa permanentná brachyterapia používa v liečbe karcinómu prostaty.
Klinické využitie brachyterapie
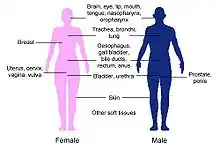
Brachyterapia sa najčastejšie využíva v liečbe karcinómu krčka maternice, prostaty, prsníka a kože. Môže byť využitá aj pri nádoroch v iných lokalitách: napr. oku, oblasti hlavy a krku, dýchacích ciest, tráviaceho traktu (pažerák, konečník), močového traktu (močový mechúr, penis), gynekologických orgánov (maternica, pošva) a v oblasti mäkkých tkanív.
Keďže zdroje žiarenia pri brachyterapii môžu byť umiestnené presne do miesta výskytu nádoru alebo do jeho blízkosti, brachyterapia dovoľuje aplikovať vysokú dávku žiarenia do relatívne malého objemu s možnosťou maximalizovať ochranu okolitých zdravých tkanív a tým aj zachovať funkciu postihnutého orgánu.
Pri použití HDR brachyterapie môže byť celková doba liečby skrátená výrazným spôsobom. Pacienti vyžadujú menej časté návštevy u lekára a mnohé aplikácie brachyterapie môže byť vykonané ambulantne, takže môžu pokračovať v aktivitách bežného života a v práci. Výhoda skrátenej liečby je priaznivá aj u starších pacientov a pacientov, ktorí cestujú za liečbou z domova na väčšie vzdialenosti.
Brachyterapia môže byť využitá v liečbe včasných, lokálne pokročilých ale aj metastatických ochorení. V niektorých prípadoch sú výsledky liečby porovnateľné s chirurgickým výkonom alebo externou rádioterapiou. Pri lokálne pokročilých nádoroch nie je väčšinou chirurgický výkon možné realizovať vzhľadom na rozsah ochorenia, preto ostáva liečba kombináciou brachyterapie a externej rádioterapie ako jediná možnosť. U veľmi pokročilých ochorení môže byť brachyterapia efektívne použitá na tlmenie príznakov vyplývajúcich z prítomnosti tumoru (bolesť, krvácanie, zúženie priesvitu orgánov). Kombinácia brachyterapie a chemoterapie sa využíva len zriedka.
Karcinóm krčka maternice
Veľmi častou indikáciou brachyterapie je práve zhubný nádor krčka maternice. Brachyterapia môže byť využitá v liečbe včasného ale aj lokálne pokročilého ochorenia a je štandardom v liečbe v mnohých krajinách sveta. Kombinácia brachyterapie s externou rádioterapiou má lepšie liečebné výsledky ako externá rádioterapia samostatne. V liečbe sa využívajú LDR, PDR aj HDR zdroje žiarenia, pričom výsledky liečby použitím rôznych príkonov sú porovnateľné. Hlavnou výhodou HDR liečby je krátky čas aplikácie a tým lepší komfort pre pacientku.
Karcinóm prostaty
Brachyterapia prostaty môže byť vykonaná formou HDR dočasnej aplikácie, alebo častejšie formou LDR permanentnej aplikácie (rádioaktívne zrná). Permanentná LDR aplikácia je vhodná pre pacientov s lokalizovaným ochorením a veľmi dobrou prognózou. Opakovanými klinickými štúdiami bolo dokumentované, že pre týchto pacientov ide o vysoko efektívnu liečbu zabezpečujúcu výbornú kontrolu ochorenia. Prežívanie pacientov liečených brachyterapiou je porovnateľné s prežívaním pacientov po externej rádioterapii alebo chirurgickom výkone (radikálna prostatektómia) pričom výskyt nežiaducich účinkov (impotencia a inkontinencia) sú pri brachyterapii menšie. Samotný výkon trvá približne 3 hodiny a väčšinou sa realizuje počas 4 – 6 dňovej hospitalizácie. Pacient sa môže vrátiť po výkone k bežným aktivitám už za niekoľko dní. LDR permanentná brachyterapia predstavuje najmenej invazívny výkon v liečbe karcinómu prostaty.
HDR brachyterapia predstavuje novší prístup k liečbe prostatického karcinómu, je však vo svete ako samostatná liečba menej používaná. Častejšie sa HDR používa na doplnenie dávky do prostaty po externej rádioterapii (vo forme tzv. HDR boostu), ktoré zabezpečí väčšie šetrenie okolitých zdravých tkanív voči samostatnej externej rádioterapii. Zaradením HDR boostu do liečby sa skráti potrebná doba pre externú rádioterapiu v porovnaní s použitím samostatnej externej rádioterapie.
Rakovina pŕs
Rádioterapia je už mnoho rokov štandardnou liečbou pri karcinóme prsníka a predstavuje integrálnu súčasť tzv. prsník zachovávajúceho liečebného prístupu (breast conserving therapy). Brachyterapia sa využíva hlavne v pooperačnom období a využíva sa najčastejšie vysoký dávkový príkon (HDR). Akcelerovaná parciálna brachyterapia prsníka (APBI, accelarated partial breast irradiation) je liečebná metóda, ktorá predstavuje efektívnu alternatívu ku klasickej pooperačnej externej rádioterapii (ktorá trvá približne 5 – 6 týždňov). Predstavuje výrazné skrátenie liečby (približne 5 dní) a zníženie dávky na okolité zdravé tkanivá pri porovnateľných liečebných výsledkoch. Takáto liečba je však určená len pre starostlivo vybraté pacientky po prsník zachovávajúcej operácii.
U vybraných pacientok je nutné po už absolvovanej externej rádioterapii doplniť dávku žiarenia do miesta, kde sa pôvodne vyskytoval nádor. Takúto liečbu nazývame boost do lôžka tumoru (dosýtenie dávky) a taktiež býva ožarovaná formou brachyterapie s vysokým dávkovým príkonom (HDR).
Hlavnou výhodou brachyterapie v porovnaní s externou rádioterapiou pri liečbe karcinómu prsníka je fakt, že vysoká dávka žiarenia je dodaná precízne do relatívne malého objemu, pričom okolité zdravé tkanivá sú viac chránené (priľahlé pľúcne tkanivo, srdce, koža). Predstavuje výrazné skrátenie trvania liečby (približne 5 dní) pri porovnateľných liečebných výsledkoch. Takýto postup (konzervatívny chirurgický výkon nasledovaný APBI) umožňuje naplno využívať výhody prsník zachovávajúceho liečebného prístupu pre pracujúce a staršie pacientky. APBI preukázala v klinických štúdiách v porovnaní s externou rádioterapiou výbornú lokálnu kontrolu ochorenia pri sledovaní 6 rokov po liečbe.
Podľa spôsobu dodania dávky sa brachyterapia v liečbe karcinómu prsníka delí na dve skupiny:
- Intersticiálna multikatétrová brachyterapia pozostáva z dočasnej aplikácie niekoľkých kovových alebo plastových (flexibilných) katétrov do tkaniva prsníka v krátkodobej celkovej anestézii. Katétre sú starostlivo umiestnené do prsníka zabezpečujúc optimálne pokrytie ožarovanej časti prsníka, pričom dávka na okolité tkanivá je minimálna. Následne sú tieto katétre pripojené na ožarovací prístroj (afterloadingový prístroj), ktorý zabezpečí presné ožiarenie. Technika intersticiálnej multikatétrovej brachyterapie sa používa na samostatnú pooperačnú rádioterapiu (APBI) ale aj pre doplnenie dávky po klasickej externej rádioterapii (boost dávka).
- Intrakavitárna balónová brachyterapia predstavuje dočasné zavedenie jedného katétra s balónom do dutiny (lôžka tumoru) pri operácii prsníka ešte počas odstránenia primárneho nádoru. Balón napojený na tento katéter je ešte počas operácie naplnený tekutinou. Následne je tento katéter pripojený na ožarovací prístroj (afterloadingový prístroj), ktorý zabezpečí presné ožiarenie. Táto technika sa v súčasnosti využíva pre samostatné pooperačné ožiarenie prsníka (APBI) hlavne v Spojených štátoch.
Vo svete existujú aj prístupy kombinujúce intersticiálnu a intrakavitárnu brachyterapiu. Takáto technika pozostáva z niekoľkých katétrov umiestnených v balóne, ktorý sa umiestňuje do dutiny po operácii. Štúdie naznačujú, že takéto usporiadanie katétrov umožňuje precíznejšie rozloženie dávky v ožarovanom objeme voči klasickej balónovej brachyterapii.
Nádory kože
HDR brachyterapia predstavuje pre nemelanómové zhubné nádory (skvamocelulárny a bazocelulárny karcinóm) alternatívu k chirurgickej liečbe. Špeciálne to platí pre ložiská umiestnené na nose, v blízkosti očí, očných viečok a pery, kde chirurgické odstránenie predstavuje zmenu výzoru pacienta alebo vyžaduje rekonštrukčný výkon (plastická chirurgia). Na zabezpečenie optimálneho rozloženia dávky a tesného kontaktu s kožou existujú viaceré druhy aplikátorov.
Brachyterapia pri liečbe kožných nádorov zabezpečuje výborný kozmetický efekt a výsledky liečby. Vo viacerých prácach s 5-ročným sledovaním brachyterapia potvrdila vysokú efektivitu v zmysle lokálnej kontroly a výsledky porovnateľné s externou rádioterapiou. Trvanie liečby nádorov kože brachyterapiu je krátke.
Vaskulárna brachyterapia
Brachyterapia môže byť použitá aj v prevencii restenóz ciev (zúženie priesvitu ciev), kedy je špeciálny katéter zavedený do vnútra ciev a ožarovanie sa realizuje cez tento katéter. Niektoré práce poukázali na to, že výhodnejšie ako použitie vaskulárnej brachyterapie je použitie DES (stentov vylučujúcich liečivá). Preto je vaskulárna brachyterapia odporúčaná hlavne pre stenózy ciev ktoré sa nedajú liečiť vyššie uvedenou metódou.
Nežiaduce účinky brachyterapie
Charakter nežiaducich účinkov závisí od miesta výskytu nádorového ochorenia a použitej techniky brachyterapie.
Akútne nežiaduce účinky
Medzi najčastejšie akútne nežiaduce účinky patria: opuch, svrbenie, modriny, poprípade dyskomfort alebo výtok v regióne, kde sa aplikovala brachyterapia. Trvanie akútnej toxicity je väčšinou krátke a tieto príznaky odoznejú do niekoľkých dní od ukončenia liečby. Krátkodobá únava môže byť tiež sprievodným prejavom tejto liečby.
Brachyterapia v liečbe nádorov krčka maternice a prostaty môže byť príčinou krátkodobých ťažkostí súvisiacich s močovým traktom, napr. retencia moču (zadržanie moču), unikanie moču, bolestí pri močení. Taktiež nutkanie na stolicu, zápcha, zvýšená frekvencia normálne formovaných stolíc až hnačky, mierne krvácanie z konečníka môžu byť príčinou brachyterapie pri vyššie uvedených ochoreniach. Akútne nežiaduce účinky zo strany dolného močového a tráviaceho traktu väčšinou odoznejú do niekoľkých týždňov od ukončenia liečby.
Pri permanentnej brachyterapii karcinómu prostaty (rádioaktívnymi zrnami) je veľmi malá šanca, že do prostaty umiestnené zrná môžu migrovať do močového mechúra alebo močovej rúry a, že pacient tieto zrná vymočí.
Pri brachyterapii kožných nádorov je najčastejším akútnym nežiaducim účinkom začervenanie a neskôr zhnednutie kože v mieste liečby, ktoré väčšinou odoznie do 5 – 8 týždňov od ukončenia liečby. Ak je nádor kože umiestnený v oblasti pery, môže následkom brachyterapie dôjsť až k vytvoreniu mokvavých ulcerácií, ktoré sa ale hoja do 4 – 6 týždňov.
Väčšina akútnych nežiaducich účinkov súvisiacich s brachyterapiou môže byť riešená bežnými liekmi alebo zmenou diéty.
Neskoré nežiaduce účinky
U malého počtu pacientov môže brachyterapia spôsobiť neskoré nežiaduce účinky s dôvodu vážneho poškodenia alebo porušenia integrity tkanív v liečenej oblasti. Neskoré nežiaduce účinky sú poväčšine miernej až strednej intenzity.
Pri liečbe nádorov prostaty alebo krčka maternice brachyterapiou môžu byť neskorým následkom liečby dlhodobé ťažkosti z dolného močového alebo tráviaceho traktu, niekedy vyžadujúce aj následnú liečbu.
Výskyt erektilnej dysfunkcie po liečbe karcinómu prostaty brachyterapiu je 15 – 30%. Samozrejme súvisí s vekom pacienta (u starších mužov je riziko vyššie), ale aj so stavom erektilnej funkcie pred samotnou liečbou. Ak erektilná dysfunkcia po brachyterapii vznikne, do značnej miery môže byť liečená liekmi. Treba podotknúť, že výskyt erektilnej dysfunkcie po brachyterapii je nižší v porovnaní s chirurgickou liečbou (radikálna prostatektómia).
Brachyterapia v oblasti kože a prsníka môže spôsobiť vytvorenie drobných jaziev v mieste aplikácie žiarenia, napriek tomu sa kozmetický efekt brachyterapie v oboch lokalitách považuje za výborný. Nekróza tuku sa môže byť tiež vytvoriť následkom brachyterapie (hlavne v oblasti prsníka). Ide o klinicky nevýznamný stav, ktorý nastupuje niekoľko mesiacov od ukončenia liečby a postihuje približne 20% pacientok.
Bezpečnosť pacientov
Pacienti liečení brachyterapiou sa často informujú ohľadom bezpečnosti svojho okolia (rodina, tehotné ženy, malé deti) po absolvovaní brachyterapie.
V prípade použitia dočasnej brachyterapie v tele pacienta neostáva žiadny rádioaktívny materiál. Riziko ožiarenia okolia teda neexistuje.
V prípade permanentnej brachyterapie prostaty (rádioaktívne zrná) sa používa materiál s nízkym dávkovým príkonom (LDR), ktorý vyžaruje len do bezprostredného okolia (niekoľko milimetrov) a jeho aktivita sa zo vzdialenosťou znižuje. Aj napriek tomu sa ako preventívne opatrenie odporúča, aby malé deti a tehotné ženy neprichádzali dlhodobo do styku z miestom na tele, ktoré obsahuje rádioaktívne zrná (napr. dlhodobé sedenie v lone pacienta s rádioaktívnymi zrnami v prostate). Pracovníci brachyterapie informujú pacienta ohľadom nevyhnutného času, po ktorý pacient musí byť opatrný voči svojmu okoliu.
Proces liečby brachyterapiou
Plánovanie brachyterapie
Pred samotným plánovaním brachyterapie je nutné, aby pacient absolvoval viaceré vyšetrenia, ktoré upresnia veľkosť a lokalizáciu nádoru a jeho vzťah k okolitým štruktúram. Medzi tieto vyšetrenia patria: klinické vyšetrenie pacienta a zobrazovacie metódy (RTG vyšetrenie, CT vyšetrenie, MRI vyšetrenie). Informácia z týchto vyšetrení umožní zobraziť nádor a jeho okolie v 3D priestore.
Informácia o nádore a jeho vzťahu k okoliu je podkladom pre plánovanie výberu optimálneho aplikátora pre konkrétneho pacienta. Aplikátor predstavuje uzavretý systém dutých trubíc vyrobený z rôzneho materiálu (napr. kov, plast), ktorý sa umiestňuje do blízkosti nádorového ložiska, alebo priamo do nádoru. Pre rôzne lokality v tele pacienta boli navrhnuté špeciálne tvary aplikátorov (napr. gynekologický aplikátor, prsníkový aplikátor).
Zavedenie aplikátorov do pacienta
Podľa charakteru plánovaného výkonu je pacient umiestnený do predpísanej polohy (napr. gynekologická poloha pri gynekologickej aplikácii). Niektoré aplikácie sa prevádzajú v krátkodobej alebo klasickej celkovej anestézii, takže sa aplikácia realizuje na brachyterapeutickej sále. Nasleduje zavedenie aplikátora do tela pacienta lekárom (bez prítomnosti rádioaktívneho zdroja).
Na určenie priestorového rozloženia aplikátorov slúžia viaceré metódy: RTG snímkovanie na simulátore alebo C-ramene, CT alebo MRI vyšetrenie aplikovanej oblasti. Pre jednotlivé druhy aplikácií (napr. gynekologická) bolo vyvinutých niekoľko dozimetrických systémov, ktoré poskytujú základné pravidlá pre výpočet dávky v brachyterapii, aby bola dosiahnutá čo najlepšia dávková distribúcia.
Až po kontrole polohy aplikátorov a výpočte dávky sú aplikátory pripojené na prístroj, ktorý automaticky zavedie rádioaktívny zdroj do aplikátorov.
Plánovanie brachyterapie

Obrazová informácia je prenesená do špeciálneho softvéru pre plánovanie brachyterapie, kde klinický fyzik vytvorí 3D virtuálny model aktuálneho pacienta a zavedených aplikátorov. V spolupráci s lekárom sa stanovia cieľové objemy a definujú požiadavky na dávky v ožarovanom objeme a okolitých štruktúrach. Klinický fyzik určí pomocou plánovacieho softvéru dávkovú distribúciu a ožarovacie časy v jednotlivých pozíciách aplikátorov. Takto pripravený ožarovací plán je zhodnotený z hľadiska pokrytia cieľového objemu a dávok na okolité kritické orgány a môže byť následne optimalizovaný. Ožarovací plán je následne schválený lekárom.
Ožiarenie
Zdroje žiarenia používané v brachyterapii bývajú uzavreté v kapsule (obale) malých rozmerov. Takýto zdroj môže byť do pacienta dopravený manuálne (ručne) alebo dnes najčastejšie automaticky (afterloadingový prístroj). Moderné afterloadingové prístroje zabezpečujú výbornú radiačnú ochranu pre personál a pacienta a presné dopravenie rádioaktívneho zdroja do aplikátorov umiestnených v pacientovi.
Pred samotným ožiarením je pacient poučený o priebehu ožarovania.
Parametre ožarovacieho plánu sú počítačovo prenesené do afterloadingového prístroja. Pacient je pripojený k ožarovaciemu prístroju pomocou prenosových trubíc a v ožarovni je počas ožiarenia sám. Následne afterloadingový prístroj automaticky zavádza rádioaktívny zdroj cez prenosové trubice až do naplánovaných pozícií v aplikátore podľa vopred pripraveného liečebného plánu. Klinický stav pacienta je sledovaný pomocou kamery a dorozumievacieho zariadenia. Po ukončení ožarovania sa zdroj žiarenia transportuje späť do afterloadingového prístroja a aplikátory sú z tela pacienta odstránené. Pacient sa po brachyterapii zotavuje väčšinou rýchlo a za pár hodín sa môže zúčastňovať normálnych aktivít. V prípade, že zavedenie aplikátorov vyžaduje celkovú anestéziu, pacient býva počas aplikácie brachyterapie hospitalizovaný, inak môže byť prevádzaná ambulantne.
Zdroje žiarenia používané v brachyterapii
| Rádionuklid | Typ žiarenia | Polčas rozpadu | Energia žiarenia |
|---|---|---|---|
| Cézium-137 (137Cs) | γ-žiarenie | 30,17 roka | 0,662 MeV |
| Kobalt-60 (60Co) | γ-žiarenie | 5,26 roka | 1,17; 1,33 MeV |
| Irídium-192 (192Ir) | γ-žiarenie | 73,8 dňa | 0,38 MeV |
| Jód-125 (125I) | γ-žiarenie | 59,6 dňa | 27,4; 31,4 a 35,5 keV |
| Paládium-103 (103Pd) | γ-žiarenie | 17,0 dňa | 21 keV |
| Ruténium-106 (106Ru) | β-žiarenie | 1,02 roka | 3,54 MeV |