Sulfid zinečnatý
Sulfid zinečnatý (zastarale sirník zinečnatý) je anorganická sůl sulfanu a hydroxidu zinečnatého se vzorcem ZnS. Jedná se o bílou, krystalickou látku (navzdory tomu, že sfalerit je tmavý), která není rozpustná ve vodě, podobně jako většina sulfidů.
| Sulfid zinečnatý | |
|---|---|
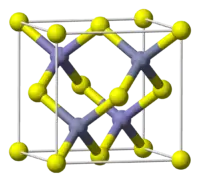
Struktura poměrně obvyklá, vyskytuje se ve sfaleritu | |
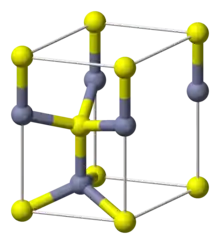
Struktura nepříliš obvyklá, vyskytuje se ve wurtzitu | |
| Obecné | |
| Systematický název | Sulfid zinečnatý |
| Ostatní názvy | Sfalerit, Wurtzit |
| Sumární vzorec | ZnS |
| Vzhled | Bílá krystalická látka |
| Identifikace | |
| Registrační číslo CAS | 1314-98-3 |
| Číslo RTECS | VZ4725000 |
| Vlastnosti | |
| Molární hmotnost | 97,474 g/mol |
| Teplota tání | 1 185 °C (sublimace) |
| Hustota | 4,1 g/cm3 |
| Rozpustnost ve vodě | Velice málo rozpustný; nerozpustný v zasaditém prostředí |
| Struktura | |
| Krystalová struktura | Krychlová |
| Bezpečnost | |
| NFPA 704 |  0
1
0
|
| Teplota vznícení | Není vznětlivý |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Výroba a reakce
Tuto látku je možno vyrábět reakcí zinečnatých solí, nejlépe rozpuštěných v rozpouštědle, a sulfidů alkalických kovů. Tato reakce se využívá v analytické chemii, vzniká bílá sraženina. Můžeme si uvést například reakci sulfidu sodného (Na2S) se síranem zinečnatým (ZnSO4), za vzniku sulfidu zinečnatého a síranu sodného (Na2SO4):
- Na2S (aq) + ZnSO4 (aq) → ZnS (s) + Na2SO4 (aq)
Průmyslově je možno tuto látku vyrábět reakcí síry s kovovým zinkem, podle rovnice:
- S8 + 8 Zn → 8 ZnS
Tato látka se především využívá na výrobu kovového zinku z přírodního sulfidu zinečnatého, který je obsažen ve sfaleritu. Reakce probíhá ve dvou stupních. Nejprve vznikne se vzdušným kyslíkem oxid zinečnatý a oxid siřičitý, který se musí zachycovat odsiřovacím zařízením, následně se z oxidu uhlíkem vyredukuje kovový zinek:
- 2ZnS + 3O2 → 2ZnO + 2SO2
- 2ZnO + C → 2Zn + CO2
Při této reakci nevzniká příliš čistý kov, dostatečně na galvanické pokovování, ale ne na chemické využití, jelikož je skoro vždy kontaminován železem, olovem, cínem, kadmiem, sírou, uhlíkem, stopami stříbra, manganu a jinými látkami. Pro chemické a farmaceutické využití se používá zinek přečištěný různými chemickými procesy.
Tato látka se silnějšími kyselinami reaguje za vzniku sirovodíku:
- ZnS + 2HCl → H2S + ZnCl2
Jelikož vznikající sulfan je toxický, řadí se ZnS mezi mírně nebezpečné látky (viz NFPA). Při požití by tato látka v žaludku reagovala se zředěnou kyselinou chlorovodíkovou, tato reakce však probíhá pomalu.
Využití

Tato látka se především využívá na výrobu zinku, rovnice je zmíněna výše. Tato látka funguje ve směsi s mědí jako luminofor. Je to levný luminofor, ale poměrně slabý. Obrázek porovnává sulfid zinečnatý a hlinitan strontnatý (se sloučeninami europia a dysprosia). Fotografie je pořízena po jedné minutě svícení. Je patrné, je hlinitan strontnatý je silnější luminofor.
Aby luminiscence probíhala, je potřeba dodat aktivátory. Pokud je použito kovové stříbro, směs svítí modrým světlem o vlnové délce 450 nm. Kovový mangan svítí oranžovo-červeně, o vlnové délce asi 590 nm. Měď způsobuje poměrně dlouho svítící zelené světlo, a je použita na obrázku.
Sulfid zinečnatý se používá jako pigment.
Externí odkazy
 Obrázky, zvuky či videa k tématu Sulfid zinečnatý na Wikimedia Commons
Obrázky, zvuky či videa k tématu Sulfid zinečnatý na Wikimedia Commons