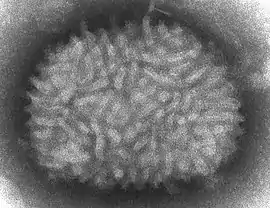
Vaccinia virus
Vaccinia virus (virus vakcinie, VACV nebo VC) je virus patřící do čeledi Poxviridae[1]. V současnosti se využívá především jako vakcína proti onemocnění pravými neštovicemi.
 | |
| Vědecká klasifikace | |
| Doména | Varidnaviria |
| Kmen | Nucleocytoviricota |
| Třída | Pokkesviricetes |
| Řád | Chitovirales |
| Čeleď | Poxviridae |
| Rod | Orthopoxvirus |
| Druh | Vaccinia virus |
| Binomické jméno | |
| Vaccinia virus | |
| Některá data mohou pocházet z datové položky. | |
Historie
Původně se vakcinace proti pravým neštovicím prováděla primitivním procesem zvaným variolace, kdy byl pacientovi podán virus variola (původce onemocnění) přímo z vředů infikované osoby pomocí insuflace nebo skarifikace. Výsledkem byly velice těžké průběhy onemocnění s vysokou úmrtností. V roku 1798 použil anglický lékař Edward Jenner k vakcinaci proti pravým neštovicím příbuzný virus kravských neštovic, což byl mnohem bezpečnější zákrok a tento způsob vakcinace se stal velice populární.[2] Po určité době se však zjistilo, že virus užívaný ve vakcínách není, nebo už dlouho nebyl, totožný s virem kravských neštovic a dostal tak jméno "vaccinia" neboli virus vakcinie.[3]
Původ viru
Virus vakcinie je původem blízký viru kravských neštovic, v minulosti se také dost často zaměňovaly.[4] Přesný původ viru však není znám.[5] Nejčastější představa o jeho původu je ta, že sdílí společného předka s virem kravských neštovic, virem variola a jinými viry z čeledi Poxviridae. Existují také spekulace o možném vzniku z viru koňských neštovic (až 99% podobnost).[6]
Charakteristika
Virus patří mezi obalené DNA-viry. DNA se skládá ze dvou lineárních řetězců, přibližně 190 kbp dlouhých, a obsahuje asi 250 genů. Virion má rozměry 360 × 270 × 250 nm, tudíž se VACV řadí mezi velké viry.[7] Množí se, na rozdíl od většiny DNA-virů, v cytoplasmě buňky, ne v jádře.[8] Komplexní genom je dostatečně veliký nato, aby se do viru mohly vkládat cizí geny, což z něj dělá ideální rekombinační vektor.[2]
Životní cyklus
Během svého životního cyklu produkuje VACV čtyři infekční formy, lišící se od sebe vnější membránou.[9]
Nejčastější formou je intracelulární zralý virion (anglicky intracelular mature virion, IMV) s jedinou lipoproteinovou vrstvou, který vzniká v cytoplazmě z neinfekčních prekurzorů a nezralé virové částice (immature virus, IV) a je odpovědný za přenos viru mezi hostiteli. IMV částice jsou pomocí mikrotubulů přenášeny k endozomům nebo k trans-Golgiho aparátu, kde se obalují dalšími dvěma vrstvami fosfolipidové membrány.[9]
Takhle vznikají intracelulární obalené viriony (intracelular enveloped virion, IEV). IEV částice se pak opět pomocí mikrotubulů pohybují k buněčnému povrchu, kde jejich vnější dvojitá membrána fúzuje s buněčnou plazmatickou membránou a částice se vystavují na povrch buňky. Pokud částice zůstává na povrchu, nazývá se buněčný obalený virion (cell enveloped virion, CEV), anebo pokud je vypuzena pryč z buňky, tak se nazývá extracelulární obalený virion (extracelular enveloped virion, EEV). CEV částice jsou důležité v mezibuněčném šíření viru, kdežto částice EEV mají roli v šíření na větší vzdálenosti.[9]
Využití jako vakcína
Jelikož orthopoxviry mají vysoce konzervovanou morfologii strukturních proteinů, aktivují v hostiteli podobné antigeny. Proto je virus vakcinie využíván hlavně jako vakcína proti příbuznému viru variola, původci pravých neštovic. V 60. až 70. letech, kdy probíhala celosvětová vakcinační kampaň proti neštovicím, propagovaná Světovou zdravotnickou organizací (WHO), pomohl tento virus k masívnímu vymýcení neštovic z populace. Po tomhle úspěchu zaznamenal vývoj vakcín na bázi VACV dramatický vývoj, který pokračuje neustále dodnes.[2]
Vakcíny 1. generace[2]
Vakcíny 1. generace se zrodili na počátku 60. let. Většina z nich byla vyráběna ve Spojených státech kultivací na zvířecí kůži (používala se kůže telat, ovcí nebo zajíců). Mezi představitelé této generace patří:
- kmen NYCBH (New York City Board of Health): k vakcinaci v USA nebo v západní Africe
- kmen Dryvax: vakcinace jen v některých amerických státech, vyráběn na kůži telat infikovaných kmenem NYCBH
- kmen EM-63: vyráběn v Sovětském svazu, sloužil k vakcinaci i v jiných zemí např. v Indii
- kmen Lister/Elstree: vyráběn britskou společností Lister Institute, na začátku 70. let byl nejrozšířenější vakcínou
- jiné kmeny: Paris, Bern, Copenhagen Tian Tian (Čína), Dairen (Japonsko)
Vakcíny 2. generace[2]
Využívaní zvířat pro produkci vakcín nevyvolávalo dobré ohlasy ve veřejnosti a časem se vyskytly také i některé výrobní potíže s kontrolou mikrobiální asepticity. Proto se spustil vývoj "vakcín 2. generace". Zde se pro výrobní účely využívali kultury tkáňových buněk nebo embryované kuřecí vajíčka (v Japonsku se užívali jejich fibroblasty).
- ACAM2000: odvozen z kmene Dryvax, od roku 2007 licencovaná vakcína ve Spojených státech
Vakcíny 3. generace[2]
Vakcíny 1. a 2. generace se ukázaly jako dostatečné prevence proti onemocnění pravých neštovic. Nicméně pořád existuje skupina lidí s kontraindikacemi, který vylučují očkování těmito typy vakcín. Proto se výzkum zaměřuje na vývoj třetí generace VACV vakcín, které by měly být bezpečnější a přitom imunogenní. Zde se už uplatňuje pozměňování divokých kmenů viru za účelem vytvoření virové částice, která se v buňkách nereplikuje nebo je značně oslabená.
Jednou z nejběžnějších metod takovéhoto pozměnění viru je vícenásobné pasážování v tkáňových kulturách z různých hostitelů. To má za následek i změnu některých vlastností viru např. genomová kompozice nebo širší hostitelská specifita.
- LC16m8 (Lister clone 16m8)
- Modified Vaccinia Ankara (MVA)
- kmen Dairen I (DIs)
Vakcíny 4. generace[2]
Čtvrtá generace vakcín je vyráběna už pokročilejšími technikami genetického inženýrství. Virus je oslabován takovými metodami jako jsou např. delece, inzerce (např. genů pro aktivaci IL-2 nebo INF-γ) nebo interrupce virových genů souvisejících s utlumováním imunitní odpovědí hostitele.
- kmen NYVAC: odvozen z kmene Copenhagen, delece 18 ORF (open reading frame) míst
- jiné příklady delece genů VACV: gen B8R (neschopnost blokace aktivity hostitelských cytokinů), B13R a B22R (oslabená replikace a patogenita), C12L (neschopnost tvořit interleukin-18 vážící protein), fragmenty s geny M1L, M2L, K1L a K2L (mutace vede k širšímu rozmezí hostitelů viru) ai.
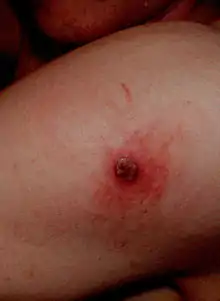
Vedlejší účinky
U zdravých jedinců se v souvislosti s vakcinací častokrát nevyskytují žádné vedlejší účinky nebo jiné zdravotní potíže, a pokud ano, tak mají jen mírný průběh (vyrážky nebo horečka). Jisté závažnější komplikace (např. kožní léze, svědění, ekzémy, atopická dermatitida, edémy, vředy, nekrózy kůže, panikulitida, nebo post-vakcinační encefalitida)[10] se vyskytovaly s použitím vakcín 1. a 2. generace nebo se vyskytují u imunodeficientních pacientů.
Další využití
Kromě vakcín může mít virus vakcinie i jiná využití. Používá se také jako vektor ve genových terapií nebo v genetickém inženýrství při vývoji rekombinantních vakcín, do kterého se vkládají geny určené pro expresi v hostiteli. Díky schopnosti indukovat silnou imunitní odpověď na antigeny spojené s tvorbou tumorů se VACV užívá i v imunoterapii jako onkolytický virus při léčbě rakoviny.[11]
Rezistence k hostiteli
Virus vakcinie vykazuje rezistenci hlavně k interferonům hostitele, a to díky proteinům kódovaných přímo v jeho genomu. Jsou to proteiny:
Odkazy
Reference
- Sherris medical microbiology : an introduction to infectious diseases. 4. vyd. New York: McGraw-Hill xiii, 979 pages s. ISBN 0-8385-8529-9, ISBN 978-0-8385-8529-0. OCLC 52358530
- JACOBS, Bertram L.; LANGLAND, Jeffrey O.; KIBLER, Karen V. Vaccinia virus vaccines: Past, present and future. Antiviral Research. 2009-10, roč. 84, čís. 1, s. 1–13. Dostupné online [cit. 2021-05-24]. DOI 10.1016/j.antiviral.2009.06.006. PMID 19563829. (anglicky)
- TUCKER, Jonathan B. Scourge: The Once and Future Threat of Smallpox. New York: Grove/Atlantic Inc., 2001. Dostupné online.
- HUYGELEN, C. [Jenner's cowpox vaccine in light of current vaccinology]. Verhandelingen - Koninklijke Academie Voor Geneeskunde Van Belgie. 1996, roč. 58, čís. 5, s. 479–536; discussion 537–538. PMID: 9027132. ISSN 0302-6469. PMID 9027132.
- Vaccines. 3. vyd. Philadelphia: W.B. Saunders Co, 1988. xix, 1230 pages s. Dostupné online. ISBN 0-7216-7443-7, ISBN 978-0-7216-7443-8. OCLC 40075804
- SCHRICK, Livia; TAUSCH, Simon H.; DABROWSKI, P. Wojciech. An Early American Smallpox Vaccine Based on Horsepox. New England Journal of Medicine. 2017-10-12, roč. 377, čís. 15, s. 1491–1492. Dostupné online [cit. 2021-05-17]. ISSN 0028-4793. DOI 10.1056/NEJMc1707600. (anglicky)
- JOHNSON, Luke; GUPTA, Amit K.; GHAFOOR, Azam. Characterization of vaccinia virus particles using microscale silicon cantilever resonators and atomic force microscopy. Sensors and Actuators B: Chemical. 2006-05, roč. 115, čís. 1, s. 189–197. Dostupné online [cit. 2021-05-17]. DOI 10.1016/j.snb.2005.08.047. (anglicky)
- TOLONEN, Nina; DOGLIO, Laura; SCHLEICH, Sibylle. Vaccinia Virus DNA Replication Occurs in Endoplasmic Reticulum-enclosed Cytoplasmic Mini-Nuclei. Molecular Biology of the Cell. 2001-07, roč. 12, čís. 7, s. 2031–2046. Dostupné online [cit. 2021-05-17]. ISSN 1059-1524. DOI 10.1091/mbc.12.7.2031. PMID 11452001. (anglicky)
- SMITH, Geoffrey L. The Formation and Function of Extracellular Enveloped Vaccinia Virus. Journal of General Virology. 2002, roč. 83, s. 2915–2931.
- JAMES, William D. Andrews' diseases of the skin : clinical dermatology.. 10th ed.. vyd. Philadelphia: Saunders Elsevier 961 s. ISBN 0-7216-2921-0, ISBN 978-0-7216-2921-6. OCLC 62736861
- VERARDI, Paulo H.; TITONG, Allison; HAGEN, Caitlin J. A vaccinia virus renaissance: New vaccine and immunotherapeutic uses after smallpox eradication. Human Vaccines & Immunotherapeutics. 2012-07, roč. 8, čís. 7, s. 961–970. Dostupné online [cit. 2021-05-17]. ISSN 2164-5515. DOI 10.4161/hv.21080. PMID 22777090. (anglicky)
- DAVIES, M V; CHANG, H W; JACOBS, B L. The E3L and K3L vaccinia virus gene products stimulate translation through inhibition of the double-stranded RNA-dependent protein kinase by different mechanisms.. Journal of Virology. 1993, roč. 67, čís. 3, s. 1688–1692. ISSN 0022-538X. DOI 10.1128/JVI.67.3.1688-1692.1993. (anglicky)
- WARREN, Luigi; MANOS, Philip D.; AHFELDT, Tim. Highly Efficient Reprogramming to Pluripotency and Directed Differentiation of Human Cells with Synthetic Modified mRNA. Cell Stem Cell. 2010-11, roč. 7, čís. 5, s. 618–630. Dostupné online [cit. 2021-05-17]. DOI 10.1016/j.stem.2010.08.012. PMID 20888316. (anglicky)
Externí odkazy
 Obrázky, zvuky či videa k tématu Vaccinia virus na Wikimedia Commons
Obrázky, zvuky či videa k tématu Vaccinia virus na Wikimedia Commons