Thioamidy
Thioamidy (také nazývané thionamidy a thiouryleny) jsou sloučeniny obsahující funkční skupinu s obecným vzorcem R–CS–NR′R″, kde R, R′ a R″ jsou organické skupiny. Jedná se o analogy amidů, které však vykazují silnější charakter násobné vazby C-N, v důsledku čehož mají vyšší energii rotační bariéry.[1]

Jedním z nejvýznamnějších thioamidů je thioacetamid, jenž se používá jako zdroj sulfidových iontů a jako stavební prvek při přípravě heterocyklických sloučenin.
Thioamidy jsou také skupinou léčiv používaných k léčbě hypertyreózy.
Příprava a struktura
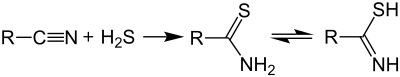
Thioamidy se nejčastěji připravují reakcemi amidů se sulfidy fosforu, jako je sulfid fosforečný; tato reakce byla objevena v 70. letech 19. století.[2][3][4][5] Další možnosti představují přípravu pomocí Lawessonova činidla a reakci nitrilů se sulfanem:
Benzylthioamidy se dají připravit Willgerodtovou-Kindlerovou reakcí.[6]
C2NH2S jádro thioamidů má rovinný tvar. U thioacetamidu mají vazby C-S, C-N a C-C postupně délky 168, 131 a 150 pm. Malé délky vazeb C-S a C-N naznačují přítomnost násobných vazeb.[7]
Thioamidy v biochemii a lékařství
Thioamidy také mohou sloužit jako léčiva proti hypertyreóze.
Thioamidy se zabudovávají do peptidů jako isostery amidových vazeb.[8]
Modifikované peptidy jsou analogy přirozených peptidů, které mohou pomáhat s objasněním vlivu struktury na aktivitu. Analogy peptidů lze také použít jako léčiva s vylepšenou biodostupností. Thioamidy inhibují enzym jodidperoxidázu ve štítné žláze, čímž omezují syntézu trijodthyroninu (T3) a thyroxinu (T4), a tak brání vstřebávání jodtyrosinů z koloidu. Rovněž zamezují uvolňování jodu z periferního hormonu.
Protože thioamidy mohou projít placentální bariérou, tak se v těhotenství musí užívat opatrně. V 0,03 % případů dochází k agranulocytóze a ojediněle se může objevit také aplastická anémie.
Příklady thioamidových léčiv jsou methimazol, karbimazol (který se in vivo mění na methimazol) a propylthiouracil.
Reference
V tomto článku byl použit překlad textu z článku Thioamide na anglické Wikipedii.
- Kenneth B. Wiberg; Paul R. Rablen. Why Does Thioformamide Have a Larger Rotational Barrier Than Formamide?. Journal of the American Chemical Society. 1995, s. 2201–2209. DOI 10.1021/ja00113a009.
- Preparation of thiamides. Journal of the Chemical Society, Abstracts. 1878, s. 396. DOI 10.1039/CA8783400392.
- R. Shabana; S. Scheibye; K. Clausen; S. O. Olesen; S.-O. Lawesson. Studies on organophosphorus compounds XXXI. Synthesis of thiolactams and thioimides. Nouveau Journal de Chimie. 1980, s. 47.
- GOMPPER, R.; ELSER, W. 2-Methylmercapto-N-Methyl-Δ2-Pyrroline. Org. Synth.. 1973. Dostupné online. (anglicky); Coll. Vol.. S. 780. (anglicky)
- SCHWARZ, George. 2,4-Dimethylthiazole. Org. Synth.. 1955. Dostupné online. (anglicky); Coll. Vol.. S. 332. (anglicky)
- ROLFS, Andreas; LIEBSCHER, Jürgen. 3-Morpholino-2-Phenylthioacrylic Acid Morpholide and 5-(4-Bromobenzoyl-2-(4-Morpholino)-3-Phenylthiophene. Org. Synth.. 1998. Dostupné online. (anglicky); Coll. Vol.. S. 99. (anglicky)
- Trevor W. Hambley; David E. Hibbs; Peter Turner; Siân. T. Howard; Michael B. Hursthouse. Insights into Bonding and Hydrogen Bond Directionality in Thioacetamide from the Experimental Charge Distribution. Perkin Transactions. 2002, s. 235–239. DOI 10.1039/B109353C.
- Dean R. Artis; Mark A. Lipton. Conformations of Thioamide-Containing Dipeptides: A Computational Study. Journal of the American Chemical Society. 1998, s. 12200–12206. DOI 10.1021/ja982398t.