Hydrogenuhličitan sodný
Hydrogenuhličitan sodný (NaHCO3) neboli jedlá soda (soda bicarbona) je bílý prášek rozpustný ve vodě za vzniku roztoku se zásaditým pH.
| Hydrogenuhličitan sodný | |
|---|---|
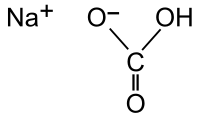 | |

Uhličitan sodný kyselý | |
 | |
| Obecné | |
| Systematický název | Hydrogenuhličitan sodný |
| Triviální název | Jedlá soda Užívací soda |
| Latinský název | Soda bicarbona |
| Anglický název | Sodium bicarbonate |
| Německý název | Natriumhydrogencarbonat |
| Sumární vzorec | NaHCO3 |
| Vzhled | Bílá krystalická látka |
| Identifikace | |
| Registrační číslo CAS | 144-55-8 |
| Číslo RTECS | VZ0950000 |
| Vlastnosti | |
| Molární hmotnost | 84,007 g/mol |
| Teplota rozkladu | 270 °C |
| Hustota | 2,211 g/cm3 (20 °C) |
| Index lomu | 1,380 (hrana a) 1,5 (hrana b) 1,586 (hrana c) |
| Rozpustnost ve vodě | 6,89 g/100 g (0 °C) 8,2 g/100 g (10 °C) 9,6 g/100 g (20 °C) 10,4 g/100 g (25 °C) 11,12 g/100 g (30 °C) 16,18 g/100 g (60 °C) 20,2 g/100 g (80 °C) 23,8 g/100 g (100 °C) |
| Rozpustnost v polárních rozpouštědlech |
1,2 g/100 g (15 °C) ethanol 7,9 g/100 g (20 °C, glycerol) |
| Relativní permitivita εr | 4,39 |
| Struktura | |
| Krystalová struktura | jednoklonná |
| Hrana krystalové mřížky | a=751 pm b=970 pm c=353 pm |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −948,1 kJ/mol |
| Standardní molární entropie S° | 102 JK−1mol−1 |
| Standardní slučovací Gibbsova energie ΔGf° | −852,3 kJ/mol |
| Izobarické měrné teplo cp | 1,043 JK−1g−1 |
| Bezpečnost | |
| R-věty | R36 |
| S-věty | S25 |
| NFPA 704 |  0
1
0
|
| Teplota vznícení | Není vznětlivý |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |

Hydrogenuhličitan sodný se používá jako součást kypřicích prášků do pečiva a šumivých prášků do nápojů, k neutralizaci poleptání kyselinou. Používá se též jako náplň do hasicích přístrojů. Dá se také použít pro bělení zubů, pro změkčení potravin vařených ve vodě, na čištění v domácnosti i na pohlcení nežádoucích pachů.
Tělo jej vylučuje v žaludku jako součást slizničního hlenu.[zdroj?!] Pokud je ho málo, žaludek se překyselí a dostaví se „pálení žáhy“. Neutralizaci žaludečních šťáv je pak možno napomoci právě konzumací jedlé sody. Ze stejného důvodu bývá součástí krmných směsí pro zvířata. Zlepšuje bachorovou výkonnost, stabilizuje pH bachoru snížením kyselosti prostředí.
Jeho tepelný rozklad probíhá podle reakce:
- 2 NaHCO3 → Na2CO3 + CO2 + H2O
Výroba
Hydrogenuhličitan sodný je prekurzorem pro výrobu uhličitanu sodného (Na2CO3). Pro výrobu se používá tzv. Solvayův proces podle rovnice:
- NH3 + H2O + NaCl + CO2 → NH4Cl + NaHCO3
Technicky se postupuje tak, že se do téměř nasyceného roztoku NaCl zavádí nejprve amoniak a poté oxid uhličitý. Vzniklý hydrogenuhličitan sodný se odfiltruje.
Odkazy
Literatura
VOHLÍDAL, JIŘÍ; ŠTULÍK, KAREL; JULÁK, ALOIS. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
Související články
- Uhličitan sodný (soda, soda na praní)
Externí odkazy
 Obrázky, zvuky či videa k tématu hydrogenuhličitan sodný na Wikimedia Commons
Obrázky, zvuky či videa k tématu hydrogenuhličitan sodný na Wikimedia Commons
