S-Nitrosoglutathion
S-Nitrosoglutathion (GSNO) je endogenní nitrosothiol (SNO), který hraje rozhodující roli při signalizaci oxidu dusnatého (NO) a je zdrojem biologicky dostupného NO. V buňkách se SNO, které slouží jako endogenní NO nosiče a dárci, neexistuje NO. SNO spontánně uvolňují NO v různých poměrech a mohou být silnými terminátory šíření radikálů volných radikálů přímou reakcí s ROO• radikály, čímž se získají nitroderiváty jako konečné produkty. [2] NO je generováno intracelulárně enzymem synthasy oxidu dusnatého (NOS): nNOS, eNOS a iNOS, zatímco in vivo zdroj mnoha SNO není znám. V okysličených pufrech však vznik SNO je způsoben oxidací NO na oxid dusnatý (N 2 O 3 ). [3] Některé důkazy naznačují, že jak exogenní NO tak endogenně odvozené NO z syntázy oxidu dusnatého mohou reagovat s glutathionem za vzniku GSNO.
| S-Nitrosoglutathion | |
|---|---|

strukturní vzorec | |
| Obecné | |
| Systematický název | 2-amino-5-({1-[(karboxymethyl)amino]-3-(nitrososulfanyl)-1-oxopropan-2-yl}amino)-5-oxopentanová kyselina |
| Triviální název | S-nitrosoglutathion |
| Ostatní názvy | γ-glutamyl(S-nitrosocysteinyl)glycin |
| Sumární vzorec | C10H16N4O7S |
| Vlastnosti | |
| Molární hmotnost | 336,32 g/mol |
| Bezpečnost | |
| [1] Varování[1] | |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
GSNOR
Enzym GSNO reduktáza (GSNOR) redukuje S- nitrosoglutathion (GSNO) na nestabilní meziprodukt, S- hydroxylaminoglutathion, který se potom upravuje za vzniku glutathionsulfonamidu nebo v přítomnosti GSH, tvoří oxidovaný glutathion (GSSG) a hydroxylamin. [4] [5] [6] Prostřednictvím tohoto katabolického procesu GSNOR reguluje buněčné koncentrace GSNO a hraje ústřední roli při regulaci hladin endogenních S- nitrosothiolů a při regulaci signalizace na bázi proteinů S -nitrosylace.
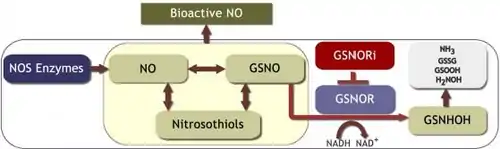
Tvorba GSNO funguje jako stabilní a mobilní NO pool, který může efektivně přenášet NO signalizaci. [7] [8] Na rozdíl od jiných messengerů s nízkou molekulovou hmotností, které se vážou na receptory receptorů cílových buněk a aktivují cílovou buněčnou funkci, je signalizace NO zprostředkována koordinačním komplexem mezi NO a přechodnými kovy nebo cílovými buněčnými proteiny, často prostřednictvím S - nitrosylace cysteinových zbytků. [9] [10] [11] Studie naznačují, že metabolismus NO má významnou roli v kardiovaskulárních a respiračních onemocněních člověka, stejně jako v imunitní toleranci během transplantace orgánů. [12] [13] [14] [15]
GSNO v medicíně
Koncentrace GSNO a NO regulují funkce dýchání modulací tónu dýchacích cest a protizánětlivými a protizánětlivými odpověďmi v respiračním traktu. [15] [16] Protože NO je nestabilní plyn a endogenní hladiny jsou obtížně manipulovatelné, bylo navrženo, že exogenní GSNO může být použita k regulaci cirkulujících hladin NO a NO derivovaných druhů a GSNO může mít funkci u pacientů s plicními onemocněními, jako je cystická fibróza . V souladu s tímto terapeutickým cílem ukázala nedávná studie, že akutní léčba aerosolizovaným GSNO byla dobře tolerována u pacientů s cystickou fibrózou. [15]
SNO v jaterních mitochondriích zřejmě ovlivňují správné fungování jater. Mitochondriální SNO-proteiny inhibují komplex I transportního řetězce elektronů; modulovat produkci mitochondriálních reaktivních druhů kyslíku (ROS); ovlivňuje vápenatě závislé otevření přechodového póru mitochondriální permeability; podporovat selektivní dovoz mitochondriálních proteinů; a stimuluje mitochondriální štěpení. Změněná redoxní rovnováha hraje zásadní roli v patogenezi onemocnění jater, včetně steatózy, steatohepatitis a fibrózy. Jednoduchost reverzibility a souhra enzymatických reakcí s nitrosaturováním a denitrizací podporují hypotézu, že SNO regulují mitochondrion pomocí redoxních mechanismů. [17]
Ve studii, která hodnotí účinky na kyselinu ursodeoxycholovou (UDCA) na tok žluči a cirhózu, se v žluči vyskytuje NO jako SNO, především GSNO. UDCA-stimulovaná biliární NO sekrece byla zrušena inhibicí iNOS s L-NAME v izolovaných perforovaných játrech a také u potkaních jater vyčerpaných z GSH buthionin sulfoximinem. Kromě toho byla biliární sekrece NO druhů významně snížena u UDCA infundovaných transportních mutantů [ATP-vazebná kazeta C2 / multirezistentní protein-spojený s proteinem 2-deficientní] krys a toto zjištění bylo konzistentní s účinkem glutathionového nosiče ABCC2 / Mrp2 v kanalikulárním transportu GSNO. U kultivovaných normálních krysích cholangiocytů GSNO aktivuje proteinovou kinázu B, chrání proti apoptóze a vede k uvolňování ATP indukované UDCA do média. [18] Retrográdní infúze GSNO do společného žlučovodu zvyšuje tok žluči a vylučování bikarbonátu. Studie dospěla k závěru, že UDCA-indukovaná biliární sekrece GSNO přispívá ke stimulaci duktální sekrece žluči.
Neuromodulátor
GSNO spolu s glutathionem a oxidovaným glutathionem (GSSG) se váže na místo rozpoznávání glutamátu receptorů NMDA a AMPA (prostřednictvím jejich γ-glutamylových skupin) a mohou být endogenními neuromodulátory . [19] [20] V milimolárních koncentracích mohou také modulovat redoxní stav komplexu receptoru NMDA. [20]
Reference
V tomto článku byl použit překlad textu z článku S-Nitrosoglutathione na anglické Wikipedii.
- S-Nitrosoglutathione. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- de Oliveira CP, de Lima VM, Simplicio FI, Soriano FG, de Mello ES, de Souza HP, Alves VA, Laurindo FR, Carrilho FJ, de Oliveira MG. Prevention and reversion of nonalcoholic steatohepatitis in OB/OB mice by S-nitroso-N-acetylcysteine treatment. J Am Coll Nutr. April 2008, s. 299–305. DOI 10.1080/07315724.2008.10719703. PMID 18689562. (anglicky)
- Giustarini D, Milzani A, Dalle-Donne I, Rossi R. Detection of S-nitrosothiols in biological fluids: a comparison among the most widely applied methodologies. J. Chromatogr. B. May 2007, s. 124–39. DOI 10.1016/j.jchromb.2006.09.031. PMID 17035104. (anglicky)
- Hedberg JJ, Griffiths WJ, Nilsson SJ, Höög JO. Reduction of S-nitrosoglutathione by human alcohol dehydrogenase 3 is an irreversible reaction as analysed by electrospray mass spectrometry. Eur. J. Biochem.. March 2003, s. 1249–56. DOI 10.1046/j.1432-1033.2003.03486.x. PMID 12631283. (anglicky)
- Jensen DE, Belka GK, Du Bois GC. S-Nitrosoglutathione is a substrate for rat alcohol dehydrogenase class III isoenzyme. Biochem. J.. April 1998, s. 659–68. PMID 9531510. (anglicky)
- Staab CA, Alander J, Morgenstern R, Grafström RC, Höög JO. The Janus face of alcohol dehydrogenase 3. Chem. Biol. Interact.. March 2009, s. 29–35. DOI 10.1016/j.cbi.2008.10.050. PMID 19038239. (anglicky)
- Dijkers PF, O'Farrell PH. Dissection of a hypoxia-induced, nitric oxide-mediated signaling cascade. Mol. Biol. Cell. September 2009, s. 4083–90. DOI 10.1091/mbc.E09-05-0362. PMID 19625446. (anglicky)
- Lima B, Forrester MT, Hess DT, Stamler JS. S-nitrosylation in cardiovascular signaling. Circ. Res.. March 2010, s. 633–46. DOI 10.1161/CIRCRESAHA.109.207381. PMID 20203313. (anglicky)
- Derakhshan B, Hao G, Gross SS. Balancing reactivity against selectivity: the evolution of protein S-nitrosylation as an effector of cell signaling by nitric oxide. Cardiovasc. Res.. July 2007, s. 210–9. DOI 10.1016/j.cardiores.2007.04.023. PMID 17524376. (anglicky)
- Hess DT, Matsumoto A, Kim SO, Marshall HE, Stamler JS. Protein S-nitrosylation: purview and parameters. Nat. Rev. Mol. Cell Biol.. February 2005, s. 150–66. DOI 10.1038/nrm1569. PMID 15688001. (anglicky)
- Kone BC. S-Nitrosylation: Targets, Controls and Outcomes. Current Genomics. August 2006, s. 301–10. Dostupné online. DOI 10.2174/138920206778604340. (anglicky)[nedostupný zdroj]
- Casey DP, Beck DT, Braith RW. Systemic plasma levels of nitrite/nitrate (NOx) reflect brachial flow-mediated dilation responses in young men and women. Clin. Exp. Pharmacol. Physiol.. December 2007, s. 1291–3. DOI 10.1111/j.1440-1681.2007.04715.x. PMID 17973870. (anglicky)
- Ganz P, Vita JA. Testing endothelial vasomotor function: nitric oxide, a multipotent molecule. Circulation. October 2003, s. 2049–53. DOI 10.1161/01.CIR.0000089507.19675.F9. PMID 14581383. (anglicky)
- Que LG, Liu L, Yan Y, Whitehead GS, Gavett SH, Schwartz DA, Stamler JS. Protection from experimental asthma by an endogenous bronchodilator. Science. June 2005, s. 1618–21. DOI 10.1126/science.1108228. PMID 15919956. (anglicky).
- Snyder AH, McPherson ME, Hunt JF, Johnson M, Stamler JS, Gaston B. Acute effects of aerosolized S-nitrosoglutathione in cystic fibrosis. Am. J. Respir. Crit. Care Med.. April 2002, s. 922–6. DOI 10.1164/ajrccm.165.7.2105032. PMID 11934715. (anglicky)
- Gaston B, Reilly J, Drazen JM, Fackler J, Ramdev P, Arnelle D, Mullins ME, Sugarbaker DJ, Chee C, Singel DJ. Endogenous nitrogen oxides and bronchodilator S-nitrosothiols in human airways. Proc. Natl. Acad. Sci. U.S.A.. December 1993, s. 10957–61. DOI 10.1073/pnas.90.23.10957. PMID 8248198. (anglicky)
- Piantadosi CA. Regulation of mitochondrial processes by protein S-nitrosylation. Biochim Biophys Acta. March 2011, s. 712–21. DOI 10.1016/j.bbagen.2011.03.008. PMID 21397666. (anglicky)
- Rodríguez-Ortigosa CM, Banales JM, Olivas I, Uriarte I, Marín JJ, Corrales FJ, Medina JF, Prieto J. Biliary secretion of S-nitrosoglutathione is involved in the hypercholeresis induced by ursodeoxycholic acid in the normal rat. Hepatology. August 2010, s. 667–77. DOI 10.1002/hep.23709. PMID 20683964. (anglicky)
- STEULLET, P.; NEIJT, H.C.; CUÉNOD, M.; DO, K.Q. Synaptic plasticity impairment and hypofunction of NMDA receptors induced by glutathione deficit: Relevance to schizophrenia. Neuroscience. 2006, s. 807–819. ISSN 0306-4522. DOI 10.1016/j.neuroscience.2005.10.014. PMID 16330153. (anglicky)
- VARGA, V.; JENEI, Zs.; JANÁKY, R.; SARANSAARI, P.; OJA, S. S. Glutathione is an endogenous ligand of rat brain N-methyl-D-aspartate (NMDA) and 2-amino-3-hydroxy-5-methyl-4-isoxazolepropionate (AMPA) receptors. Neurochemical Research. 1997, s. 1165–1171. ISSN 0364-3190. DOI 10.1023/A:1027377605054. PMID 9251108. (anglicky)
