Oxid dusitý
Oxid dusitý (N2O3) je jedním z pěti oxidů dusíku. V plynném skupenství je nestabilní, v kapalném stavu je to silně jedovatá tmavěmodrá kapalina.
| Oxid dusitý | |
|---|---|
3D model molekuly N2O3 | |
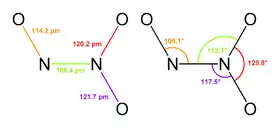
2D schéma molekuly N2O3 | |
| Obecné | |
| Systematický název | Oxid dusitý |
| Anglický název | Dinitrogen trioxide |
| Německý název | Distickstofftrioxid |
| Sumární vzorec | N2O3 |
| Vzhled | Namodralý plyn (tmavě modrá kapalina nebo krystaly) |
| Identifikace | |
| Registrační číslo CAS | 10544-73-7 |
| PubChem | 61526 |
| ChEBI | 29799 |
| Vlastnosti | |
| Molární hmotnost | 76,012 g/mol |
| Teplota tání | −102 °C |
| Teplota varu | 3 °C (rozklad na NO a NO2) |
| Hustota | 1,447 g/cm³ (2 °C) 1,782 g/cm³ (−195 °C) |
| Měrná magnetická susceptibilita | 3,81×10−6 cm3g−1 (−16 °C) |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | 83,76 kJ/mol 50,31 kJ/mol (kapalina) |
| Standardní molární entropie S° | 312,3 JK−1mol−1 |
| Standardní slučovací Gibbsova energie ΔGf° | 139,5 kJ/mol |
| Izobarické měrné teplo cp | 0,863 5 JK−1g−1 |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| R-věty | R26, R34 |
| S-věty | S1/2, S9, S26, S28,
S36/37/39, S45 |
| NFPA 704 |  0
3
0
OX
|
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Výroba
Oxid dusitý vzniká reakcí oxidu dusnatého (NO) a oxidu dusičitého (NO2) za teploty nižší než −21 °C.
- NO + NO2 → N2O3
Tato sloučenina je však stabilní pouze v pevném a kapalném stavu, při dosažení bodu varu (3 °C) se rychle rozkládá zpět na NO a NO2.
Využití
Oxid dusitý nemá žádný technický význam. Teoreticky sice může být použitý při výrobě kyseliny dusité (HNO2):
- N2O3 + H2O → 2 HNO2,
ale takto vzniklá kyselina dusitá je velice nestabilní a rychle se rozkládá za vzniku kyseliny dusičné, oxidu dusnatého a vody:
- 3 HNO2 → HNO3 + 2 NO + H2O.
Reference
- Dinitrogen trioxide. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
Literatura
- Jiří Vohlídal, Alois Julák, Karel Štulík: Chemické a analytické tabulky, Grada, Praha 1999, ISBN 80-7169-855-5
- František Jursík: Anorganická chemie nekovů, Vysoká škola chemicko-technologická, Praha 2002, ISBN 80-7080-504-8
- Heinrich Remy: Anorganická chemie – I. díl, Státní nakladatelství technické literatury, Praha 1961
- Norman Neill Greenwood, Alan Earnshaw: Chemie prvků – svazek I, Informatorium, Praha 1993, ISBN 80-85427-38-9
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.



