Mycobacterium tuberculosis
Mycobacterium tuberculosis (MTB) je patogenní bakterie z rodu Mycobacterium. Způsobuje většinu případů tuberkulózy.[1] Poprvé byla objevena Robertem Kochem v roce 1882. Má neobvyklý voskový plášť na povrchu buňky (především z kyseliny mykolové), který je nepropustný pro Gramovo barvení; místo něj se proto používají acid-fast techniky. M. tuberculosis je vysoce aerobní, bakterie potřebuje vysoké hladiny kyslíku. Primárně je tato bakterie patogenem v dýchací ústrojí savců, napadá plíce, kde způsobuje tuberkulózu.[1]
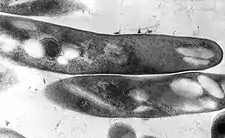 M. tuberculosis | |
| Vědecká klasifikace | |
| Doména | bakterie (Bacteria) |
| Kmen | aktinobakterie (Actinobacteria) |
| Řád | Actinomycetales |
| Podřád | Corynebacterineae |
| Čeleď | Mycobacteriaceae |
| Rod | Mycobacterium |
| Binomické jméno | |
| Mycobacterium tuberculosis Zopf; 1883 | |
| Některá data mohou pocházet z datové položky. | |
Genom M. tuberculosis byl sekvenován v roce 1998.[2][3]
Fyziologie
M. tuberculosis se řadí mezi obligátně aerobní bakterie; to znamená, že ke svému životu nutně potřebuje kyslík. Kvůli vysokému obsahu lipidů ve své buněčné stěně se nebarví Gramovým barvením, ale pro její vizualizaci se používá barvení Ziehl-Neelsenovo. Přestože z empirických důvodů by nemělo být řazeno mezi Gram-pozitivní bakterie (neváže krystalovou violeť), může být klasifikováno jako acidorezistentní Grampozitivní bakterie kvůli nepřítomnosti vnější buněčné membrány.[1]
M. tuberculosis se dělí přibližně jednou za 15–20 hodin, což je extrémně pomalu v porovnání s jinými bakteriemi, které mají generační dobu v řádech minut (Escherichia coli se dělí po 20 minutách). Jedná se o malou tyčkovitou bakterii (bacil), která je odolná proti dezinfekčním prostředkům a ve vysušeném stavu může přečkat i týdny životaschopná. Její buněčná stěna s vysokým obsahem lipidů (zejména kyseliny mykolové) pravděpodobně způsobuje její vysokou rezistenci a je také klíčovým faktorem virulence.[4]
Po průniku do plic je M. tuberculosis fagocytováno alveolárním makrofágem, který ale není schopen bakterii usmrtit. Jeho buněčná stěna totiž brání splynutí fagozomu a lysozomu blokováním můstkové molekuly EEA1 (Early Endosomal Autoantigen 1). Nicméně blokace této molekuly nebrání splývání fagozomu s váčky naplněnými živinami. Bakterie se následně nekontrolovatelně množí uvnitř makrofágu. Genom M. tuberculosis také obsahuje UreC gen, který brání okyselení fagozomu.[5] Bakterie makrofág zabije a unikne z něj pomocí neutralizace prostředí dusíkem.
Schopnost vybudovat různé mutanty M. tuberculosis a zkoumat tím funkci jednotlivých produktů genů pro specifické funkce znamenala významný pokrok v pochopení mechanismů jeho patogenity a faktorů virulence, kde hraje roli mnoho sekretů a vylučovaných proteinů.[6]
Druhové variace
M. tuberculosis je geneticky variabilní a vykazuje tím charakteristické rozdíly ve fenotypu u jednotlivých izolovaných kmenů. Tato různorodost vykazuje biogeorafický výskyt a jednotlivé linie jsou spojeny s geografickými oblastmi. Fenotypové studie však tvrdí, že tato variabilita nemá dopad na vývoj nových diagnostických metod a vakcín. Variace však ovlivňují relativní odolnost kmene a dynamiku přenosu u kmenů odolných vůči antibiotikům.[7]
Hypervirulentní kmeny
Vyšší výskyt tuberkulózy je často způsoben jejími hypervirulentními kmeny. Tyto klinické izoláty vykazují v laboratorních testech nezvyklou imunopatologii a mohou být buď vysoce tvořící zánět nebo naopak zánět potlačující. Studie prokázaly, že většina hypervirulentních mutantů má v buněčné stěně nepřítomný enzym nebo regulátor, který tvoří odpověď na stimulaci prostředí. Zjistilo se také, že tyto kmeny mají mechanismy, které dovolují M. tuberculosis maskovat svůj plný patogenní potenciál vyvoláním granulomu, který poskytuje efektivní útočiště a dovoluje bacilu vydržet dlouho trvající infekci.[8]
Mikroskopický obraz
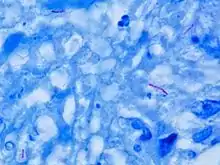
M. tuberculosis je charakterizováno tím, že způsobuje zanícenou granulovanou tkáň (granulom) obsahující Langhansovy obří buňky, které mají podkovovitý vzor jádra. Organismy jsou také rozpoznány červenou barvou při Ziehl-Neelsenovo barvení.
Genom
Genom kmene H37Rv byl publikován v roce 1998.[9] Obsahuje 4 milionů párů bází a 3959 genů. 40 % procent těchto genů má již svou funkci charakterizovanou a funkce dalších 44 % je odhadována. Nachází se zde také 6 pseudogenů. Genom obsahuje 250 genů zúčastněných v metabolismu mastných kyselin a 39 těchto genů je potřebných k metabolismu polyketonů tvořících voskovitý obal. Takto vysoký počet dochovaných genů poukazuje na evoluční význam voskovitého obalu pro přežití patogenu.
10 % kódující kapacity je převzato dvěma rozsáhlými genovými rodinami, které kódují kyselé bílkoviny bohaté na glycin. Tyto proteiny mají zachovaný motiv na N-konci, jehož delece poškozuje růst uvnitř makrofágu a granulómu.[10]
Diagnóza
Sputum se odebere tři po sobě následující rána, jelikož by počet organismů mohl být malý, a vzorek se naloží do 3% KOH nebo NaOH ke zkapalnění a dekontaminaci. Nemělo by se přistupovat ke Gramovu barvení, jelikož M. tuberculosis je „acidorezistentní bacil“. Nejčastější metoda vizualizace je barvení dle Ziehl-Neelsona, acidorezistentní bakterie jsou pak zbarveny světle červeně, což je vysoce kontrastní oproti modrému pozadí, proto je bakterie někdy nazývána červená tečka (red snapper).[11] Důvod pro acid-fast barvení je kvůli tlusté voskované buněčné stěně.[12]. Voskovitost buněčné stěny je způsobena hlavně přítomností mykolových kyselin, tato stěna je odpovědná za typický sýrovitý granulom během tuberkulózy. Složka, která toto způsobuje – trehalóza dimykolát – se nazývá cord factor.
Existuje systém odstupňování pro interpretaci mikroskopických nálezů založený na počtu nalezených organismů. Pacienti s plicní tuberkulózou vykazují AFB (acid-fast bacilu) ve svém sputu jen v polovině případů, což znamená, že i když nejsou pozorovány žádná mycobacteria, je potřebné i další vyšetření. Acidorezistentní bakterie také mohou být vizualizovány pomocí fluorescenční mikroskopie barvením směsí auramin-rhodamin, které je zbarví do zlatého odstínu.
M. tuberculosis také roste na selektivním médiu známém jako Lowensteinovo-Jensenovo, které se pro tyto účely běžně používá. Nicméně tato metoda je poměrně pomalá, jelikož organismus potřebuje 6 až 8 týdnů k růstu, což velmi zpožďuje získání výsledků. Rychlejší výsledek může být získán použitím média Middlebrookova.
Je nutné také vzít v potaz, že během pokročilého stádia tuberkulózy může M. tuberculosis napadnout téměř každou část těla, což znamená, že vzorky by měly být zvoleny dle uvážení (například při střevní tuberkulóze odebrat stolici a tak dále).
Pro diagnózu byla také vyvinuté immunochromatografické sérologické vyšetření.[13]
Historie
M. tuberculosis byl prvně popsán 24. března 1882 Robertem Kochem, který následně za svůj objev dostal v roce 1905 Nobelovu cenu za fyziologii a medicínu; bakterie je také známá pod označením „Kochův bacil“.[14]
Reference
V tomto článku byl použit překlad textu z článku Mycobacterium tuberculosis na anglické Wikipedii.
- Ryan KJ, Ray CG (editors). Sherris Medical Microbiology. 4th. vyd. [s.l.]: McGraw Hill, 2004. ISBN 0-8385-8529-9.
- Cole ST, Brosch R, Parkhill J, et al.. Deciphering the biology of Mycobacterium tuberculosis from the complete genome sequence. Nature. June 1998, roč. 393, čís. 6685, s. 537–44. DOI 10.1038/31159. PMID 9634230.
- Camus JC, Pryor MJ, Médigue C, Cole ST. Re-annotation of the genome sequence of Mycobacterium tuberculosis H37Rv. Microbiology (Reading, Engl.). October 2002, roč. 148, čís. Pt 10, s. 2967–73. Dostupné online. PMID 12368430.
- Murray PR, Rosenthal KS, Pfaller MA. Medical Microbiology. [s.l.]: Elsevier Mosby, 2005.
- Bell E. Vaccines: A souped-up version of BCG. Nature Reviews Immunology. October 2005, roč. 5, čís. 10, s. 746. DOI 10.1038/nri1720.
- Wooldridge K (editor). Bacterial Secreted Proteins: Secretory Mechanisms and Role in Pathogenesis. [s.l.]: Caister Academic Press, 2009. Dostupné online. ISBN 978-1-904455-42-4.
- Gagneux S. Mycobacterium: Genomics and Molecular Biology. [s.l.]: Caister Academic Press, 2009. Dostupné online. ISBN 978-1-904455-40-0. Kapitola Strain Variation and Evolution.
- Casali N. Mycobacterium: Genomics and Molecular Biology. [s.l.]: Caister Academic Press, 2009. Dostupné online. ISBN 978-1-904455-40-0. Kapitola Hypervirulent Mycobacterium tuberculosis.
- Mycobacterium tuberculosis [online]. Sanger Institute, 2007-03-29 [cit. 2008-11-16]. Dostupné online.
- Glickman MS, Jacobs WR. Microbial pathogenesis of Mycobacterium tuberculosis: dawn of a discipline. Cell. February 2001, roč. 104, čís. 4, s. 477–85. Dostupné online. DOI 10.1016/S0092-8674(01)00236-7. PMID 11239406.
- Flowers T. Quarantining the noncompliant TB patient: catching the "Red Snapper". Journal of health and hospital law : a publication of the American Academy of Hospital Attorneys of the American Hospital Association. 1995, roč. 28, čís. 2, s. 95–105. PMID 10141473.
- Madigan M, Martinko J (editors). Brock Biology of Microorganisms. 11th. vyd. [s.l.]: Prentice Hall, 2005. ISBN 0-13-144329-1.
- Reddy JR, Kwang J, Lechtenberg KF, Khan NC, Prasad RB, Chengappa MM. An immunochromatographic serological assay for the diagnosis of Mycobacterium tuberculosis. Comp. Immunol. Microbiol. Infect. Dis.. January 2002, roč. 25, čís. 1, s. 21–7. DOI 10.1016/S0147-9571(01)00016-9. PMID 11831744.
- Robert Koch and Tuberculosis: Koch's Famous Lecture [online]. Nobel Foundation, 2008 [cit. 2008-11-18]. Dostupné online.
Externí odkazy
 Obrázky, zvuky či videa k tématu Mycobacterium tuberculosis na Wikimedia Commons
Obrázky, zvuky či videa k tématu Mycobacterium tuberculosis na Wikimedia Commons - Databáze sekvencí genomu Mycobacterium tuberculosis a související informace