DNA čip
DNA čip (často i v našem prostředí nazýván anglickým názvem DNA microarray) je technologie umožňující molekulárně-biologické analýzy výrazně paralelního rázu, především analýzu exprese genů.


Jedná se o destičku (povětšinou skleněnou nebo silikonovou), s mnoha (běžně desetitisíci, výjimečně až miliony) vzorky jednovláken DNA oligonukleotidů. Tyto vzorky se nazývají vlastnosti (features) a každý z nich obsahuje několik molekul jednoho konkrétního DNA oligonukleotidu. Po kontaktu takovéto destičky s testovaným vzorkem – směsí označených DNA oligonukleotidů – molekuly vzorku (nazývané cílové) hybridizují s komplementárními molekulami přichycenými na destičce. Poté jsou (typicky na bázi fluorescence) detekována místa, kde došlo k hybridizaci a je tak zjištěno, jaké molekuly oligonukleotidů vzorek obsahoval.
I jediný experiment produkuje velké množství dat, proto je pro porozumění výsledků takřka vždy nutné použít metody bioinformatiky. V dnešní době existuje několik firem, produkujících DNA čipy komerčně (např. Affymetrix, Agilent Technologies, Eppendorf či Illumina), rovněž jsou ale hojně vytvářeny přímo ve výzkumných laboratořích pro vlastní potřebu. Obdobou DNA čipů jsou RNA čipy a proteinové čipy.
Historie DNA microarray
Za počátky DNA microarray se pokládá hybridizace kolonií bakterie E. coli provedená Grunsteinem a Hognesem, 1975. Bakterie E. coli obsahují různorodé hybridní plazmidy a díky jejich metodě bylo možné rychle zjistit specifické sekvence DNA nebo geny, které se na daném plazmidu nacházejí. Kolonie E. coli byly přesunuty na nitrocelulózový filtr, zlyzovány a jejich DNA byla denaturována a přichycena na filtr in situ. Poté se pomocí přihybridizované radioaktivní RNA označila místa zájmu na DNA. Grundstein a Hognes pomocí této metody izolovali kolonie obsahující plazmid s genem z Drosophily melanogaster pro 18 a 28S rRNA.[1] Na počátku 90. let skupina Hanse Lehracha zautomatizovala tento proces pomocí robotického systému, který rychle uspořádával klony z destičky na filtr.[2] Na přelomu tisíciletí došlo k rychlému pokroku zapojením fluorescenční detekce, která je citlivější a levnější než radioaktivní značení. Začaly se využívat delší sekvence (25-60 bp) díky rozšíření sekvenování genomů, a s tím souvisejícím rozvojem databází genomů. Tyto inovace vedly ke zvýšení specificity čipů. Například byl vytvořen referenční čip pro člověka, Lennon 1996.[2][3] Byly vyvinuty 3 rozdílné typy mikročipů: „čipy na sklíčku“ (spotted arrays on glas), „samo skládající se čipy“ (self assembled arrays) a „in situ syntetizované čipy“ (in situ synthesized arrays).[4]
Princip a technologie
Metoda DNA čipů je založena na paralelní hybridizaci značených sekvencí nukleových kyselin ze vzorku se specifickými sondami ukotvenými na podkladu. Fixováním sond na pevný povrch je umožněno je prostorově oddělit a paralelizovat hybridizační reakce. Nukleotidová sekvence je základem pro specificitu daných sond. Od konce 20. let došlo k masivnímu rozvoji této technologie, nejenom k její adaptaci k mnoha různým účelům, ale i k vývoji řady dalších jejích variací. Vzhledem k prudkému rozvoji na trhu komerčních DNA čipů a tím se zvyšující konkurence, se efektivně snižuje finanční náročnost této technologie.[5]
Rozdělení
V současnosti jsou používané technologie značně rozdílné a můžeme je rozdělit do různých kategorií.
Podle počtu sond
- Nízkohustotní ("low-density")
Nesoucí desítky až stovky specifických oligonukleotidových sond, přidělaných na speciální membrány nebo podložní sklíčka. Často zaměřeny na analýzu specifických signálních drah nebo na soubory biomarkerů.
- Vysokohustotní ("hish-density")
Nesoucí tisíce až miliony specifických sond, umožňujících stanovení exprese jednotlivých exonů, velmi podrobné mapování úseku genomové DNA, genotypizaci statisíců jednonukleotidových polymorfismů nebo resekvenování rozsáhlých úseků DNA. Zaměřeny na výzkum v oblasti analýzy genomové DNA nebo exprese RNA.
Podle druhu sond
- Oligonukleotidové
Nejrozšířenější typ DNA čipů v současnosti, neboť je použitelný pro skoro všechny aplikace. Existují dva druhy, s krátkými nebo dlouhými oligonukleotidy.
- cDNA (komplementární "complementary" DNA)
V současnosti téměř kompletně vytlačena dlouhými oligonukleotidy. Komplementární DNA (cDNA) je syntetizována reversní transkripcí z RNA templátu pomocí enzymu reversní transkriptáza (RT).[6]
- BAC (bakteriální artificiální chromozomy) , PAC (P1-odvozené arteficiální chromozomy)
Využívány ke konstrukci DNA čipů pro komparativní genomovou hybridizaci.
Podle technologie přípravy (viz Výroba)
- Depotované ("spotované")
- In-situ syntetizované
- "Bead arrays"
Podle způsobu značení vzorků
- Fluorescenční
Nejrozšířeněji používaná metoda značení. Dovoluje současnou analýzu více vzorků označených různými spektrálně se nepřekrývajícími fluorofory. Vzorek tedy při analýze bude svítit více barvami. Nejčastěji používanými fluorescenčními barvivy jsou například Cyanine 3, Cyanine 5 a FITC. Existují dvě hlavní skupiny značení vzorků. Mezi první skupinu metod patří inkorporace značených nebo speciálně upravených nukleotidů do RNA nebo DNA během přípravy vzorků. Dělí se na značení přímé ("direct labeling") a nepřímé ("indirect labeling"). U přímého jsou přímo zabudovány fluorescenčně značené nukleotidy. U nepřímého jsou nejprve inkorporovány speciálně upravené nukleotidy, na které je následně navázáno vlastní fluorescenční barvivo nebo nukleotidy značené biotinem, které jsou poté detekovány pomocí streptavidinu konjugovaného s fluorescenčním barvivem. Druhá skupina využívá tzv. koncové značení ("end labeling"). Značené nukleotidy jsou připojeny na 3´ nebo 5´ konec DNA/RNA určené k hybridizaci pomocí specifických enzymů jako TdT (terminální deoxynukleotidyl transferáza) nebo T4 RNA ligáza. Dále existuje neenzymatické značení nukleových kyselin, kdy je fluorescenční barvivo navázáno na adaptér, schopný pevné vazby s DNA, RNA i proteiny.
- Chemiluminiscenční
- Radionuklidové
Podle počtu snímaných barev
- Jednokanálové
Tuto techniku upřednostňují velké firmy dodávající komerční výrobky (Affymetrix, Illumina).
- Dvoukanálové
Dvoubarevná metoda umožňuje sledovat větší počet analyzovaných vzorků a porovnat dva vzorky za naprosto stejných experimentálních podmínek.
- Vícekanálové
Nejméně rozšířená metoda, neboť dochází k překryvu fluoroforů a neexistují spolehlivé statistické metody pro analýzu vícebarevných uspořádání.
Podle aplikace
- RNA aplikace
3 možné aplikace: sledování exprese mRNA, exonů nebo krátkých RNA. Celkové zlepšování analytických a sekvenačních metod umožňuje detailní analýzy transkriptomu pomocí DNA čipů. Exonové DNA čipy obsahují reprezentativní sondy pro jednotlivé exony a ne pro jednotlivé geny, což umožňuje podrobnější a kvalitativně lepší analýzu genové exprese a alternativního sestřihu exprimovaných genů. Studium krátkých RNA pomocí DNA microarray je obtížné hlavně kvůli návrhu sond, které musí být dostatečně specifické i při velké sekvenční homologii různých krátkých RNA. Rozdíl mezi některými sekvencemi krátkých RNA může totiž být pouze jeden nukleotid.[5]
- DNA aplikace
5 možných aplikací: arrayCGH, genotypizace (SNP array), ChIP-on-chip, resekvenování a analýza methylace DNA. CGH, neboli komparativní genomová hybridizace je metoda umožňující analýzu celého genomu v jednom experimentu. ArrayCGH jsou určeny pro sledování změn v počtu kopií úseků DNA. Více používané jsou SNP ("single nucleotide polymorphism") microarray, které kombinují v jednom produktu dvě analýzy, genotypizaci a CNV ("copy number variation"). ChiP-on-chip ("Chromatin immunoprecipitation on chip") a analýza methylace DNA jsou epigenetické analýzy založené na metodě "tilling microarray". Ta využívá sondy s velikou hustotou pokrytí navržené tak, aby rovnoměrně pokrývaly určité úseky genomu. K resekvenování jsou v současné době používány především DNA s krátkými oligonukleotidy.[5]
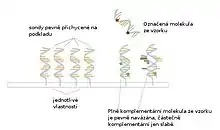
Průběh experimentu
DNA čip je založen na principu párování komplementárních bází nukleotidů – spojení vodíkovými můstky. Možných postupů při experimentu je více, tradiční experiment pro zjištění genů exprimovaných v jedné buňce v daném okamžiku lze popsat zhruba takto:
- Vytvoření DNA čipu: Vybrané DNA oligonukleotidy – jednovlákna (například části genů, genové reportéry) známých sekvencí, nazývaná sondy jsou speciálními metodami přichyceny k povrchu destičky pevnou kovalentní vazbou. Vždy několik stejných molekul na jednom místě tvoří tzv. vlastnost, vlastnosti jsou na destičce prostorově odděleny.
- Vytvoření vzorku: Typickým příkladem vzorku je všechna mRNA přítomná v určité buňce v určitém okamžiku. Vzorek musí být nejdříve purifikován ("vyčištěn"), (např. elektroforézou, PCR se specifickými primery) poté je reversní transkripcí převeden do cDNA. Dále může proběhnout amplifikace pomocí PCR pro zajištění dostatečného počtu molekul požadovaných typů ve vzorku a dělení molekul cDNA na kratší pomocí restrikčních endonukleáz. Během reverzní transkripce, PCR amplifikace či po nich probíhá nezbytný krok označení molekul. Ke každé molekule je připojeno několik molekul (typicky zhruba jedna na každých 60 bází) fluorescentní (popř. jiné, např. radioaktivní) látky, jejíž přítomnost, popř. množství bude možno později detekovat. Typickými fluorescenčními látkami používanými pro tyto pokusy jsou fluorofory. Molekuly vzorku jsou před aplikací na čip denaturovány. Výsledným vzorkem je tedy směs jednovláken DNA označených detekovatelnou látkou.
- Hybridizace vzorku s čipem: Po kontaktu s DNA čipem molekuly vzorku hybridizují s komplementárními sondami (molekulami na čipu). Čím větší je sekvenční podobnost (resp. komplementarita, viz nukleová báze) sond s molekulami vzorku, tím větší počet vodíkových můstků mezi nimi vznikne a tím pevnější je vazba.
- Omytí čipu: Po omytí zůstanou na čipu sondy, pevně přichycené kovalentní vazbou k jeho povrchu a molekuly vzorku přichycené dostatečně pevně na sondách. Molekuly vzorku přichycené na sondách nedostatečným počtem vodíkových můstků, tedy nedostatečně sekvenčně podobné, jsou odplaveny.
- Skenování čipu: Po Skenování čipu: Po excitaci laserem vyzáří molekuly barviva (způsob s použitím fluorescentního barviva) přítomné na molekulách vzorku přichycených na sondách světlo určité vlnové délky. Světlo vyzářené každou vlastností je detekováno.
- Zpracování výsledků: Předchozím postupem získáme informaci o tom, ke kterým sekvencím uchyceným na čipu existovaly komplementární sekvence ve vzorku. Podle intenzity vyzářeného světla lze určit i množství komplementárních molekul přítomných ve vzorku, běžně se ovšem pracuje pouze s relativním množstvím. Jsou tedy pouze porovnávána množství světla vyzářená jednotlivými vlastnostmi pro zjištění poměrů, v jakých byly jednotlivé sekvence ve vzorku přítomny. Zjištění absolutní koncentrace jednotlivých sekvencí ve vzorku je problematické. Charakter získaných dat vyžaduje pokročilé počítačové zpracování. Nejdříve je třeba digitální zpracování obrazu, získaná data jsou potom analyzovány metodami bioinformatiky.
- Analýza dat: Prvním z několika kroků je převod obrazové informace na numerická data, které je pak možno dále zpracovávat. Primární data jsou totiž v podobě digitalizovaného obrazu, protože k detekci vazby vzorku na čip jsou používány hlavně optické metody jako fluorescence nebo chemiluminiscence. Pro vlastní statistické zpracování je nutné data upravit tak, aby byl minimalizován vliv nebiologických zdrojů variability. K tomuto účelu slouží metody pro normalizaci dat. Normalizace umožňuje porovnání expresních hodnot genů mezi různými hybridizacemi nebo v případě dvoukanálových technik porovnání míry genové exprese ve vzorcích označených různými fluorofory.[5]


Dvoukanálový experiment
Popsaný postup může být upraven požitím směsi dvou vzorků (např. ze zdravých a rakovinných buněk či z buněk jednoho druhu v různých podmínkách) označených různými barvivy (typicky červeným a zeleným). Výsledkem je potom relativní informace o rozdílu v expresi genů mezi vzorky, lze tak jednoduše zjistit například které geny jsou vlivem nemoci v buňkách podexprimované a které nadexprimované. Tímto způsobem bude použit pouze jeden místo dvou čipů, což snižuje cenu. Nevýhodou je však horší porovnatelnost výsledků s jinými experimenty a také fakt, že pokud je jeden ze vzorků nekvalitní, znehodnotí i analýzu druhého, byť kvalitního vzorku.
Výroba
Existuje mnoho variant postupů při výrobě DNA čipů, dva základní přístupy jsou tyto:
- Tištěné DNA microarray: Vyrábí se natisknutím chemicky syntetizovaných oligonukleotidových sekvencí na povrch mikročipu. Tyto sekvence jsou roboticky nakapány nebo natištěny na velmi jemnou mřížku. Na poklad jsou nanášeny nano až picolitry roztoku s nukleovými kyselinami v takových odstupech, aby nedošlo ke kontaminaci. Nejčastěji využívaným povrchem microarray je sklo, jelikož je celkem stabilní vůči vyšším teplotám a oplachování, umožňuje dobrou hybridizační kinetiku, má minimální fluorescenční šum na pozadí. V neposlední řadě, jeho používání je ekonomicky dobře dostupné.
- In situ syntetizované microarray: Tento princip výroby využívá fotolitografii. Celá podkladová destička je nejdříve zakryta inertním materiálem, ten je poté na požadovaných místech odkryt a destička je vnořena do směsi obsahující pouze nukleotidy jednoho druhu. Ty se po jednom přichytí na odkrytá místa. Destička je opět zakryta, odkryta na dalších místech dle plánu a ponořena do směsi s dalším nukleotidem. Takto jsou postupně syntetizovány celé požadované sekvence. Tento přístup je vhodný na čipy s kratšími oligonukleotidy.
- Vysoko-hustotní kuličkové DNA microarray: Technologie založena na barevně-kódované 3micron silikových korálcích, které se sami náhodně složí do vlákna a následně na destičku. Hustota sekvencí navázaných na korálcích je 40 000 na mm2 a to je 400x větší hustota než na tištěných microarray. Každý korálek je pokryt sta tisíci stejných kopií oligonukleotidů.[7]
Využití
Analýza genové exprese
Hlavním využitím DNA čipů je měření úrovně genové exprese.
Příkladem mohou být bakteriální kultury: Určování bakteriálních kultur
DNA microarray napomáhá k analýze bakteriální genomové DNA. S rostoucím počtem rezistentních bakterií k antibiotikům, dochází k neúčinné léčbě bakteriálních onemocnění. V současnosti není tato metoda hojně využívána, ale je považována za jednu z možností medicinální diagnostiky v budoucnosti, výhodou je, že stačí pouze malé množství DNA, metoda je mnohem rychlejší, než pěstování celých bakteriálních kultur na misce. Bakteriální kultury lze určovat i v jiných odvětvích, než je medicína, například určení bakterií z půdy. [8]
Analýza vazby transkripčních faktorů
Využití čipů v kombinaci s chromatinovou imunoprecipitací k určení vazebných míst transkripčních faktorů.
Genotypování
Způsob genotypizace jednonukleotidových polymorfismů SNP (Single-Nucleotide-Polymorfism). Nejvíce používanou metodou k detekci SNP je allelová diskriminace hybridizací, alelově specifické prodlužování a ligace na “bar-code“ oligo, který je následně hybridizovaný na univerzální čip.
Celogenomové studie
S rozvojem genových databází je umožněno lépe definovat role genů pomocí vzorů jejich exprese na úrovni celého genomu. K první celogenomové studii genové exprese byla použita jako modelový organismus Arabidopsis thaliana, která má pro tento účel širokou škálu výhod. Jako gen-specifické cíle bylo použito 45 klonovaných Arabidopsis cDNA a 3 další cDNA sloužily jako kontrola. Sekvence byly amplifikovány pomocí PCR a umístěny na 96 jamkovou destičku. Vzorky z destičky byly natištěny na podložní sklíčka, teplotně a chemicky zpracovány tak, aby se DNA sekvence přichytily na povrch a denaturovaly. Fluorescenční sondy byly připraveny z kompletní Arabidopsis mRNA jedním kolem reversní transkripce. Výsledná značená cDNA byla hybridizována na esej a následně skenována laserem. Detektor byl saturován na většině cílových míst. Diferenciální genová exprese byla měřena na základě simultánního, dvoubarevného hybridizačního systému. Fluorescenční sondy, připravené z dvou zdrojů mRNA pomocí reversní transkriptázy byly smíchány, hybridizovány na esej a postupně skenovány. Ke zjištění komplexnějších změn vzorů exprese, byl proveden druhý pokus sledující mRNA z kořenů a listů. Porovnáním výsledků skenování byly zjištěny rozšířené změny v genové expresi mezi listy a kořeny. Autoři také naznačují, jak by se tento druh studie dal použít ke sledování a porovnávání exprese genů v lidském genomu. Odhadovaných 100 000 genů v lidském genomu výrazně převyšuje počet genů Arabidopsis. Tento skromný nárůst komplexity naznačuje, že podobné cDNA čipy, připravené z rychle rostoucího repertoáru lidských EST (expressed sequence tags), by mohly být využity k určení vzorů exprese desetitisíců lidských genů v rozlišných typech buněk.[9]
Nádorová biologie
DNA čipy se také hojně využívají v nádorové biologii. Sondy s cDNA ze zdravých buněk jsou porovnávány se sondami z buněk nádorových. Komplementární DNA je smíchána a vzorek je nanesen na čip. Následuje skenování a vyhodnocení dat. Díky DNA microarray se pak dá určit, jak se liší genové exprese v buňkách nádorových od buněk netransformovaných. Na tyto geny a jejich produkty, pak lze například zaměřit léčbu.
Omezení microarray
DNA čipy fungují na principu nepřímého měření relativní koncentrace – měřený signál by měl odpovídat množství přihybridizované DNA. Dochází zde ale k omezení hybridizační kinetiky a měřený signál není vždy lineární k množství navázané DNA. Při velkém množství stejných hybridizujících úseků na DNA, dochází k saturaci čipu, v opačném případě při velmi nízkých koncentracích nevzniká žádný signál, i přesto, že je DNA přihybridizovaná. Další problém se týká především savčích genomů, které obsahují velké množství podobných sekvencí. Pokud máme například gen A a k němu blízké homology geny B, C DNA čip je může detekovat také jako gen A, což vede k falešným výsledkům. Problematická je také detekce genových produktů, které mají více sestřihových variant. Musíme si také uvědomit, že DNA čipy jsou schopné detekovat pouze sekvence, které jsou známé a byla pro ně vytvořena komplementární sekvence na čipu. To může být problematické u druhů, které mají vysoce variabilní genom.[2]
Reference
- GRUNSTEIN, M.; HOGNESS, D. S. Colony hybridization: a method for the isolation of cloned DNAs that contain a specific gene. Proceedings of the National Academy of Sciences of the United States of America. October 1975, roč. 72, čís. 10, s. 3961–3965. PMID: 1105573 PMCID: PMC433117. Dostupné online [cit. 2018-04-12]. ISSN 0027-8424. PMID 1105573.
- BUMGARNER, Roger. DNA microarrays: Types, Applications and their future. Current protocols in molecular biology / edited by Frederick M. Ausubel ... [et al.]. 2013-1, roč. 0 22, s. Unit–22.1.. PMID: 23288464 PMCID: PMC4011503. Dostupné online [cit. 2018-04-12]. ISSN 1934-3639. DOI 10.1002/0471142727.mb2201s101. PMID 23288464.
- LENNON, G. G.; LEHRACH, H. Hybridization analyses of arrayed cDNA libraries. Trends in genetics: TIG. October 1991, roč. 7, čís. 10, s. 314–317. PMID: 1781028. Dostupné online [cit. 2018-04-12]. ISSN 0168-9525. PMID 1781028.
- DERISI, J.; PENLAND, L.; BROWN, P. O. Use of a cDNA microarray to analyse gene expression patterns in human cancer. Nature Genetics. December 1996, roč. 14, čís. 4, s. 457–460. PMID: 8944026. Dostupné online [cit. 2018-04-12]. ISSN 1061-4036. DOI 10.1038/ng1296-457. PMID 8944026.
- TICHÝ, Boris. Možnosti využití DNA microarray v diagnostice a terapii nádorů. [online]. Brno: 30.09.2010 [cit. 2018-04-12]. Dostupné online.
- BIOLABS, New England. Reverse Transcription (cDNA Synthesis) | NEB. www.neb.com [online]. [cit. 2018-04-12]. Dostupné online. (anglicky)
- MILLER, Melissa B.; TANG, Yi-Wei. Basic Concepts of Microarrays and Potential Applications in Clinical Microbiology. Clinical Microbiology Reviews. 2009-10, roč. 22, čís. 4, s. 611–633. PMID: 19822891 PMCID: PMC2772365. Dostupné online [cit. 2018-04-12]. ISSN 0893-8512. DOI 10.1128/CMR.00019-09. PMID 19822891.
- GOVINDARAJAN, Rajeshwar; DURAIYAN, Jeyapradha; KALIYAPPAN, Karunakaran. Microarray and its applications. Journal of Pharmacy & Bioallied Sciences. 2012-8, roč. 4, čís. Suppl 2, s. S310–S312. PMID: 23066278 PMCID: PMC3467903. Dostupné online [cit. 2018-04-24]. ISSN 0976-4879. DOI 10.4103/0975-7406.100283. PMID 23066278.
- SCHENA, Mark; SHALON, Dari; DAVIS, Ronald W. Quantitative Monitoring of Gene Expression Patterns with a Complementary DNA Microarray. Science. 1995-10-20, roč. 270, čís. 5235, s. 467–470. PMID: 7569999. Dostupné online [cit. 2018-04-24]. ISSN 0036-8075. DOI 10.1126/science.270.5235.467. PMID 7569999. (anglicky)