Fluorescence
Fluorescence je typ luminiscence, která se dále dělí na elektroluminiscenci, fotoluminiscenci, radioluminiscenci a chemiluminiscenci. Využívá se v chemii, fyzice i biologii.

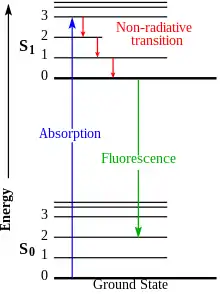
Fluorescence je způsobena absorpcí fotonů systémem v základním stavu, který tím přejde do excitovaného stavu. Při deexcitaci se systém nevrátí až do základního stavu, ale je emitován foton s nižší energií, což odpovídá delší vlnové délce, než foton, který byl absorbován.[1] Jev byl poprvé popsán v roce 1852 George Gabriel Stokesem .[2]
Princip fluorescence
Fluorescence popisuje jev, kdy molekulární systém absorbuje a poté emituje světlo. Kratší vlnová délka světla (vyšší energie) vyzáří elektrony pro přechod ze základní stavu do excitovaného stavu.
Jakmile je v tomto stavu a po zpoždění několika nano-sekund (životnost fluorescence), elektrony se uvolní zpět do základního stavu a uvolní svou uloženou energii v emitovaném fotonu. Díky mechanismu relaxace s vyšší energií má toto emitované světlo nižší energii (delší vlnovou délku) než absorbované světlo. Rozdíl mezi excitací a emisní energií (vlnová délka) se nazývá Stokesův posun.
Některé proteiny (fluorofory) mohou podléhat fluorescenci. Vyzařují světlo na různých vlnových délkách, obvykle v širokém pásmu 10 nanometrů. Obecně jsou fluorofory rozděleny do dvou hlavních typů, fluorescenčních proteinů a fluorescenčních barviv.
Proteiny mohou být geneticky kódovány pro expresi a značení specifických proteinů ve studované buňce. Pro tyto potřeby byla vyvinuta fluorescenční barviva s malými molekulami (obvykle z kyaninu nebo fluoresceinových sloučenin) pro použití při imunologickém značení endogenních molekul. Vývoj značení pomocí fluoroforů umožnil nové pozorování biologických systémů například pomocí fluorescenční mikroskopie nebo průtokové cytometrie. [3]
Aspekty fluorescence
Intenzita
Intenzita fluorescence je sledování změny celkového světelného výkonu. To se následně používá ke kvantifikaci biochemické reakce. Tento typ sledování je často využíván v enzymatických testech (např. proteázách, lipázách). Existují dvě varianty - fluorogenní testy a testy fluorescenčního zhášení. V testech fluorescenčního zhášení je fluorescenční skupina kovalentně navázána na substrát. Po štěpení se uvolní fluorescenční skupina, což vede ke zvýšení intenzity fluorescence.[4]
Spektrální složení
Fluorescenční excitační spektrum charakterizuje elektronovou distribuci molekuly v základním stavu. Excitace je ekvivalentní absorpci, protože po absorpci molekula dosáhne excitovaného stavu Sn. Fluorescenční excitační spektrum se získá fixací emisní vlnové délky a spuštěním excitačního monochromátoru.[5]
Polarizace
Polarizace fluorescence je výkonným nástrojem pro studium molekulárních interakcí sledováním změn ve zjevné velikosti fluorescenčně značeného ligandu. Podobně jako u scintilačních proximitních testů, polarizace umožňuje vědci prohlížet molekulární vazebné události v roztoku, což umožňuje skutečnou rovnovážnou analýzu do nízkého pikomolárního rozsahu. Měření polarizace neovlivňují vzorky, takže je lze zpracovat a znovu analyzovat, aby se zjistil vliv na vazbu takovými změnami, jako je pH, teplota a koncentrace solí. Teorie polarizace fluorescence je založena na pozorování, že když je malá fluorescenční molekula excitována rovinně polarizovaným světlem, je emitované světlo do značné míry depolarizováno, protože molekuly se během své fluorescenční životnosti rychle přeskupují v roztoku.[6]
Využití fluorescence
Ratiometrie
Existuje třída fluorochromů, které jsou určeny k měření změn v intracelulárním prostředí, souhrnně známé jako poměrové barvy. Tato barviva, jako je fura, BCECF a beta-laktamáza, jsou fluorochromy s duální excitací nebo duální emisí, které mají vícenásobné absorpční (excitační) / emisní charakteristiky. Aby se přesně změřily změny fluorescence, je často vyžadováno použití filtračních kol, protože přepínání mezi jednopásmovými filtračními soupravami by znamenalo riziko posunutí vzorku a následného nesprávného vyrovnání finálních obrazů.
FRET (Fluorescence resonance energy transfer)
FRET je jev, kdy „excitovaná“ donorová fluoroforová molekula přenáší energii v neradiačním procesu na vhodnou akceptorovou fluoroforovou molekulu. Tento přenos energie se nazývá „neradiační“, protože k němu dochází bez emise fotonu z fluoroforu dárce. Místo toho zahrnuje přímý přenos energie donorové molekuly v excitovaném stavu, když se její fluorescenční emisní spektrum překrývá s excitačním spektrem akceptorového fluoroforu. Výsledný signál FRET z akceptoru je často označován jako „senzitizovaná emise“.
TIRF (Total Internal Reflection Fluorescence)
TIRF je technika, která byla vyvinuta k omezení fluorescence na pozadí a ke zvýšení poměru signál k šumu ve výsledných obrazech. Toho je dosaženo v TIRF pomocí schopnosti světla vytvářet evanescentní vlnu (nebo pole) ve velmi omezeném rozsahu ve vzorku za rozhraní dvou substrátů lišících se indexem lomu. [7]
Průtoková cytometrie (FACS)
průtoková cytometrie umožňuje na základě značení pomocí fluorescenčních značek identifikovat, analyzovat a případně třídit buněčné subpopulace v suspenzi.
Reference
- Fluorescence. Chemistry LibreTexts [online]. 2013-10-02 [cit. 2020-07-03]. Dostupné online. (anglicky)
- G. G. Stokes: Phil. Trans. 142, 1852, S. 463–562.
- Principles of Fluorescence - ESRIC - Edinburgh Super-Resolution Imaging Consortium. www.esric.org [online]. [cit. 2020-07-03]. Dostupné v archivu pořízeném dne 2020-07-05.
- CRONK, D. Chapter 8 - High-throughput screening. Příprava vydání RG Hill, HP Rang. [s.l.]: Churchill Livingstone Dostupné online. ISBN 978-0-7020-4299-7. S. 95–117. (anglicky) DOI: 10.1016/B978-0-7020-4299-7.00008-1.
- ALBANI, J. R. Chapter 2 - Fluorescence: Principles and Observables. Příprava vydání J. R. Albani. Amsterdam: Elsevier Science Dostupné online. ISBN 978-0-444-51449-3. S. 55–98. (anglicky) DOI: 10.1016/B978-044451449-3/50002-2.
- HEUVEL, J. P. V. 2.03 - Receptor Theory and the Ligand–Macromolecule Complex. Příprava vydání Charlene A. McQueen. Oxford: Elsevier Dostupné online. ISBN 978-0-08-046884-6. S. 27–50. (anglicky) DOI: 10.1016/B978-0-08-046884-6.00203-7.
- ADMIN. Fluorescence Applications. www.chroma.com [online]. 2014-03-10 [cit. 2020-07-03]. Dostupné online. (anglicky)