Kyselina gentisová
Kyselina gentisová je organická sloučenina patřící mezi dihydroxybenzoové kyseliny. Jedná se o derivát kyseliny benzoové a vedlejší (podíl kolem 1 %) produkt metabolického rozkladu aspirinu, vylučovaný ledvinami.[2]
| Kyselina gentisová | |
|---|---|
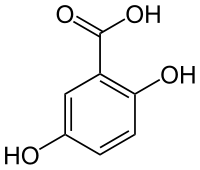
Strukturní vzorec | |

Model molekuly | |
| Obecné | |
| Systematický název | kyselina 2,5-dihydroxybenzenkarboxylová |
| Ostatní názvy | kyselina 2,5-dihydroxybenzoová |
| Sumární vzorec | C7H6O4 |
| Vzhled | bílý až žlutý prášek |
| Identifikace | |
| Registrační číslo CAS | 490-79-9 |
| PubChem | 3469 |
| ChEBI | 17189 |
| SMILES | O=C(O)c1cc(O)ccc1O |
| InChI | 1S/C7H6O4/c8-4-1-2-6(9)5(3-4)7(10)11/h1-3,8-9H,(H,10,11) |
| Vlastnosti | |
| Molární hmotnost | 154,12 g/mol |
| Teplota tání | 199,5 °C (472,6 K)[1] |
| Rozpustnost ve vodě | 0,5 g/100 ml (5 °C)[1] |
| Bezpečnost | |
| [1] Varování[1] | |
| H-věty | H302 H315 H319 H335[1] |
| P-věty | P261 P264 P270 P271 P280 P301+312 P302+352 P304+340 P305+351+338 P312 P321 P330 P332+313 P337+313 P362 P403+233 P405 P501[1] |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Vyskytuje se v africkém stromu Alchornea cordifolia a ve víně.[3]
Výroba
Kyselina gentisová se vyrábí karboxylací hydrochinonu.[4]
- C6H4(OH)2 + CO2 → C6H3(CO2H)(OH)2
Tato přeměna je příkladem Kolbeho–Schmittovy reakce
Další možností je příprava z kyseliny salicylové Elbsovou peroxodisíranovou oxidací.[5][6]
Reakce
Za přítomnosti enzymu gentisát 1,2-dioxygenázy reaguje kyselina gentisová s kyslíkem za vzniku kyseliny 3-maleylpyrohroznové.
Použití
Protože tato kyselina patří mezi hydrochinony, tak se snadno oxiduje a má využití jako antioxidant v některých léčivých přípravcích.
V laboratořích se používá jako matrice při MALDI hmotnostní spektrometrii[7] a dají se za její přítomnosti detekovat peptidy obsahující zbytky kyseliny borité.[8]
Reference
V tomto článku byl použit překlad textu z článku Gentisic acid na anglické Wikipedii.
- 2,5-Dihydroxybenzoic acid. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- G. Levy; T. Tsuchiya. Salicylate accumulation kinetics in man. New England Journal of Medicine. 1972-09-31, s. 430–432. DOI 10.1056/NEJM197208312870903. PMID 5044917.
- Comparison of Phenolic Acids and Flavan-3-ols During Wine Fermentation of Grapes with Different Harvest Times. Rong-Rong Tian, Qiu-Hong Pan, Ji-Cheng Zhan, Jing-Ming Li, Si-Bao Wan, Qing-Hua Zhang and Wei-Dong Huang, Molecules, 2009, 14, pages 827-838, DOI:10.3390/molecules14020827
- Phillip M. Hudnall "Hydroquinone" in Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim. 2005 Wiley-VCH, Weinheim. DOI:10.1002/14356007.a13_499
- R. U. Schock; D. L. Tabern. The Persulfate Oxidation of Salicylic Acid. 2,3,5-Trihydroxybenzoic Acid. The Journal of Organic Chemistry. 1951, s. 1772–1775. DOI 10.1021/jo50005a018.
- E. J. Behrman. Organic Reactions, Volume 35. [s.l.]: John Wiley & Sons, 1988. Dostupné online. ISBN 978-0471832539. S. 440.
- K. Strupat; M. Karas; F. Hillenkamp. 2,5-Dihidroxybenzoic acid: a new matrix for laser desorption-ionization mass spectrometry. International Journal of Mass Spectrometry and Ion Processes. 1991, s. 89–102. DOI 10.1016/0168-1176(91)85050-V. Bibcode 1991IJMSI.111...89S.
- J. Crumpton; W. Zhang; W. L. Santos. Facile Analysis and Sequencing of Linear and Branched Peptide Boronic Acids by MALDI Mass Spectrometry. Analytical Chemistry. 2011, s. 3548–3554. DOI 10.1021/ac2002565. PMID 21449540.
