Isokyanidy
Isokyanidy (také nazývané isonitrily nebo karbylaminy) jsou organické sloučeniny obsahující funkční skupinu -N≡C, ta je izomerní s nitrilovou (kyanidovou) skupinou -C≡N; názvoslovná předpona je isokyano-.[1] Organický zbytek je na skupinu navázán přes dusík, zatímco u nitrilů se váže přes uhlík. Isokyanidy se použřívají jako výchozí látky na přípravu dalších sloučenin.
Vlastnosti
Struktura
Vazby C-N u isokyanidů jsou krátké, v případě methylisokyanidu jde o 115,8 pm. Velikosti úhlů C-N-C jsou blízko 180°.[2]
Podobně jako oxid uhelnatý mají isokyanidy dvě rezonanční struktury, jednu s trojnou vazbou a jednu s dvojnou vazbou mezi dusíkovým a uhlíkovým atomem. Volný pár π elektronů u dusíku je příčinou lineárního tvaru skupiny, i když isokyanidy reagují částečně jako karbeny. Z tohoto vyplývá, že obě rezonanční struktury dobře popisují skutečný stav;[3] díky nim u isokyanidů dochází k polymerizaci.[3]
Spektroskopické vlastnosti
Infračervená spektra isokyanidů vykazují silnou absorpci při vlnočtech 2165 až 2110 cm−1.[4] Elektronová symetrie v jádrech 14N v molekulách isokyanidů vede k pomalé kvadrupólové relaxaci, takže lze pozorovat 13C-14N jaderný spin.[4]
Toxicita
Některé isokyanidy (například cyklohexylisokyanid) jsou toxické, zatímco ostatní nevykazují významnou toxicitu.[5] Isokyanidy také často silně zapáchají.
Příprava
Z kyanidu stříbrného
Prvním připraveným isokyanidem byl allylisokyanid, a to reakcí allyljodidu s kyanidem stříbrným.[6]
- RX + AgCN → RNC + AgX
Alkylací kyanidu alkalického kovu obvykle vznikne nitril, ovšem stříbrný kation chrání koncový atom uhlíku.
Z formamidů
Isokyanidy se často připravují dehydratací formamidů. K dehydrataci lze použít toluensulfonylchlorid, oxychlorid fosforečný, fosgen, difosgen a nebo Burgessovo činidlo za přítomnosti zásady, například pyridinu či triethylaminu.[7][8][9]
- RNHC(O)H + ArSO2Cl + 2C5H5N → RNC + [C5H5NH]+[ArSO3]– + [C5H5NH]+Cl–
Z dichlorkarbenů
Při karbylaminové reakci reaguje hydroxid alkalického kovu s chloroformem za vzniku dichlorkarbenu, který následně reaguje s primárním aminem, čímž se tvoří isokyanid. Příkladem může být příprava terc-butylisokyanidu z terc-butylaminu za přítomnosti benzyltriethylamoniumchloridu jako katalyzátoru:[10]
- (CH3)3CNH2 + CHCl3 + 3 NaOH → (CH3)3CNC + 3 NaCl + 3 H2O
Jelikož jde o jedinou známou reakci specifickou pro primární aminy, tak se často používá k důkazu jejich přítomnosti.
Reakce
Isokyanidy nereagují se silnými zásadami (často vznikají v silně zásaditém prostředí), ale reagují s kyselinami. Ve vodných roztocích kyselin se hydrolyzují na odpovídající formamidy:
- RNC + H2O → RN(H)C(O)H
Tato reakce se využívá k odstranění zápachu isokyanidů. Některé isokyanidy se za přítomnosti Lewisových a Brønstedových–Lowryho kyselin polymerizují.[11]
Isokyanidy se účastní mnoha vícesložkových reakcí v organické syntéze, jako jsou Ugiho reakce a Passeriniho reakce.
Také mohou podstoupit cykloadiční reakce, jako například [4+1] cykloadiční reakci s tetraziny.[12] V závislosti na počtu substituentů na isokyanidu vznikají karbonylové sloučeniny nebo stabilní cyklické produkty.[13] Isokyanidy také mohou reagovat s vazbami C–Cl u acylchloridů.
Isokyanidy také mohou být reaktanty v reakcích, katalyzovaných palladiem, s mnoha dalšími sloučeninami.[14]
Pozice α v molekulách isokyanidů vykazuje zřetelnou kyselost; například benzylisokyanid má pKa 27,4, zatímco pKa fenylacetonitrilu je 21,9.[15] V plynném skupenství je CH3NC o 7,5 kJ/mol méně kyselý než CH3CN.[16]
Isokyanidy jako ligandy
_6Cation.png.webp)
Isokyanidy vytvářejí komplexy s většinou přechodných kovů.[17], reagují přitom jako analogy oxidu uhelnatého. Příkladem je terc-butylisokyanid, který tvoří komplex Fe2(tBuNC)9, analogický k Fe2(CO)9.[18] I když mají tyto komplexy podobnou strukturu jako příslušné komplexy CO, tak jsou v některých vlastnostech odlišné, převážně z toho důvodu, že t-BuNC je lepší donorový ligand než CO. Fe(t-BuNC)5 se tak na rozdíl od Fe(CO)5 protonuje snadno.[19]
Výskyt v přírodě
Isokyanidovou funkční skupinu obsahuje pouze několik málo přírodních látek. První taková byla objevena roku 1957 v extraktu z plísně Penicillium chrysogenum. Tato látka, pojmenovaná xanthocillin, byla později používána jako antibiotikum. Posléze bylo z přírodních zdrojů získáno několik dalších isokyanidů. Většina isokyanidů z mořských organismů patří mezi terpenoidy, zatímco některé isokyanidy u suchozemských organismů jsou deriváty α aminokyselin.[20]
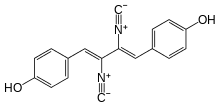 Xanthocillin je jednou z mála známých přírodních látek obsahujících isokyanidovou funkční skupinu (zde dokonce dvě).
Xanthocillin je jednou z mála známých přírodních látek obsahujících isokyanidovou funkční skupinu (zde dokonce dvě).
Reference
V tomto článku byl použit překlad textu z článku Isocyanide na anglické Wikipedii.
- IUPAC Goldbook isocyanides
- M. Kessler; H. Ring; R. Trambarulo; W. Gordy. Microwave Spectra and Molecular Structures of Methyl Cyanide and Methyl Isocyanide. Physical Review. 1950, s. 54–56. Bibcode 1950PhRv...79...54K.
- R. Ramozzi; N. Chéron; B. Braïda; P. C. Hiberty; P. Fleurat-Lessard. A Valence Bond View of Isocyanides' Electronic Structure. New Journal of Chemistry. 2012, s. 1137–1340.
- R. W. Stephany; M. J. A. de Bie; W. Drenth. A 13C-NMR and IR study of isocyanides and some of their complexes. Organic Magnetic Resonance. 1974, s. 45–47.
- I. Ugi; U. Fetzer; U. Eholzer; H. Knupfer; K. Offermann. Isonitrile Syntheses. Angewandte Chemie International Edition. 1965, s. 472–484.
- W. Lieke. Über das Cyanallyl. Annalen der Chemie und Pharmacie. 1859, s. 316–321.
- R. E. Schuster; J. E. Scott. Methyl isocyanide. Organic Syntheses. 1966, s. 75.
- Ivar Karl Ugi; R. Meyr. Neue Darstellungsmethode für Isonitrile. Angewandte Chemie. 1958, s. 702–703.
- Siobhan Creedon; H. Kevin Crowley; Daniel G. McCarthy. Dehydration of formamides using the Burgess Reagent: a new route to isocyanides. Perkin Transactions. 1998, s. 1015–1018.
- G. W. Gokel; R. P. Widera; W. P. Weber. Phase-transfer Hofmann Carbylamine Reaction: tert-Butyl Isocyanide. Organic Syntheses. 1988, s. 232.
- Deming, T. J.; Novak, B. M. "Mechanistic Studies on the Nickel Catalyzed Polymerization of Isocyanides" J. Am. Chem. Soc. 1993, 115, 9101.
- P. Imming; R. Mohr; E. Müller; W. Overheu; G. Seitz. [4 + 1]Cycloaddition of Isocyanides to 1,2,4,5-Tetrazines: A Novel Synthesis of Pyrazole. Angewandte Chemie International Edition. 1982, s. 284.
- H. Stöckmann; A. Neves; S. Stairs; K. Brindle; F. Leeper. Exploring Isonitrile-Based Click Chemistry for Ligation with Biomolecules. Organic & Biomolecular Chemistry. 2011, s. 7303–7305. PMID 21915395.
- S. Lang. Unravelling the labyrinth of palladium catalysed reactions involving isocyanides. Chemical Society Reviews. 2013, s. 4867–4880. PMID 23443313.
- Bordwell pKa Table (Acidity in DMSO) [online]. [cit. 2018-12-20]. Dostupné online.
- Jonathan Filley; Charles H. DePuy; Veronica M. Bierbaum. Gas-phase negative-ion chemistry of methyl isocyanide. Journal of the American Chemical Society. 1987-09-01, s. 5992–5995. ISSN 0002-7863.
- Eric Singleton, Hester E. Oosthuizen "Metal Isocyanide Complexes"Advances in Organometallic Chemistry 1983, Volume 22, Pages 209–310. DOI:10.1016/S0065-3055(08)60404-9
- Bassett, J.M.; Barker, G.K.; Green, M.; Howard, J.A.; Stone, G.A.; Wolsey, W.C. "Chemistry of low-valent metal isocyanide complexes" J.C.S. Dalton, 1981, 219-227.
- Bassett, J.-M.; Farrugia, L. J.; F. G. A. Stone "Protonation of pentakis(t-butyl isocyanide)iron" J.C.S. Dalton, 1980, 1789-1790. DOI:10.1039/DT9800001789
- P. J. Scheuer. Isocyanides and Cyanides as Natural Products. Accounts of Chemical Research. 1992, s. 433–439. ISSN 0002-7863.