Hydrogensulfid sodný
Hydrogensulfid sodný je anorganická sloučenina se vzorcem NaHS. Jedná se o produkt částečné neutralizace kyseliny sulfanové (H2S) hydroxidem sodným. NaHS se používá na přípravu organických i anorganických sloučenin síry; může být použit jako pevná látka, častěji však nachází využití v podobě vodného roztoku. Pevný NaHS je bezbarvý a vyznačuje se podobným zápachem jako H2S, protože se rozkládá působením vzdušné vlhkosti. Na rozdíl od sulfidu sodného (Na2S), který je nerozpustný v organických rozpouštědlech, je NaHS jakožto 1:1 elektrolyt lépe rozpustný. Roztoky HS− jsou citlivé na vzdušný kyslík, který je mění na polysulfidy, což se projevuje žlutým zabarvením.
| Hydrogensulfid sodný | |
|---|---|
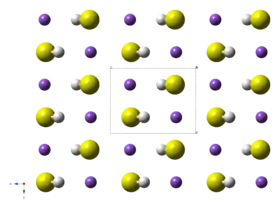
Struktura | |
| Obecné | |
| Systematický název | hydrogensulfid sodný |
| Funkční vzorec | NaSH |
| Sumární vzorec | HNaS |
| Vzhled | bílé krystaly[1] |
| Identifikace | |
| Registrační číslo CAS | 16721-80-5 |
| EC-no (EINECS/ELINCS/NLP) | 240-778-0 |
| PubChem | 15337 |
| SMILES | [Na+].[SH-] |
| InChI | 1S/Na.H2S/h;1H2/q+1;/p-1 |
| Vlastnosti | |
| Molární hmotnost | 56,062 g/mol |
| Teplota tání | 350 °C (623 K)[1] |
| Hustota | 1,79 g/cm3[1] |
| Rozpustnost ve vodě | 50 g/100 ml (22 °C)[1] |
| Rozpustnost v polárních rozpouštědlech |
rozpustný v ethanolu[1] |
| Rozpustnost v nepolárních rozpouštědlech |
rozpustný v diethyletheru[1] |
| Bezpečnost | |
| [1] | |
| H-věty | H226 H251 H290 H301 H314 H318 H400[1] |
| P-věty | P210 P233 P234 P235+410 P240 P241 P242 P243 P260 P264 P270 P273 P280 P301+310 P301+330+331 P303+361+353 P304+340 P305+351+338 P310 P321 P330 P363 P370+378 P390 P391 P403+235 P404 P405 P407 P413 P420 P501[1] |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Příprava
Obvyklá laboratorní příprava hydrogensulfidu sodného spočívá v reakci methoxidu sodného (NaOMe) se sulfanem:[2]
- NaOMe + H2S → NaHS + MeOH
Čistotu NaHS lze zjistit jodometrickou titrací, kdy se využívá redukce I2 ionty HS−.
Bezvodý hydrogensulfid sodný se dá získat reakcí sodíku s plynným sulfanem za nepřítomnosti vody a kyslíku.[3]
Struktura a vlastnosti
Krystalický NaHS má při teplotách nad 360 K strukturu NaCl, z čehož vyplývá, že HS− se chová jako kulovitý anion, který rychle rotuje. Pod 360 K vytváří kosočtverečnou strukturu, kde má HS− diskovitý tvar. Za teplot nižších než 114 K se jeho struktura stává jednoklonnou. Odpovídající rubidné a draselné soli se chovají podobně.[4]
NaHS taje při 350 °C. Kromě bezvodé formy se může vyskytovat i ve dvou hydratovaných formách, jako NaHS·2H2O a NaHS·3H2O. Všechny tři formy jsou bezbarvé a mají podobné, i když ne zcela stejné, vlastnosti.
Lze jej použít k vysrážení hydrogensulfidů ostatních kovů přidáním do vodných roztoků příslušných solí. Podobně jako u analogického hydroxidu sodného jde o silnou zásadu.
Použití
Ročně se vyrobí několik tisíc tun NaHS. Využití má například při výrobě papíru, jako flotační látka při extrakci mědi z rud, kde aktivuje oxidové minerály, a v kožedělném průmyslu, kde se pomocí něj odstraňují vlasy z kůží.
Reference
V tomto článku byl použit překlad textu z článku Sodium hydrosulfide na anglické Wikipedii.
- https://pubchem.ncbi.nlm.nih.gov/compound/28015
- R. I. Eibeck. Sodium Hydrogen Sulfide. Inorganic Syntheses. 1963, s. 128–131. ISBN 978-0-470-13238-8. DOI 10.1002/9780470132388.ch35.
- J. W. Pavlik, B. C. Noll, A. G. Oliver, C. E. Schulz, W. R. Scheidt, “Hydrosulfide (HS−) Coordination in Iron Porphyrinates”, Inorganic Chemistry, 2010, vol. 49(3), 1017-1026.
- F. Haarmann; H. Jacobs; E. Roessler; J. Senker. Dynamics of anions and cations in hydrogensulfides of alkali metals (NaHS, KHS, RbHS): A proton nuclear magnetic resonance study. The Journal of Chemical Physics. 2002, s. 1269–1276. DOI 10.1063/1.1483860.
Externí odkazy
 Obrázky, zvuky či videa k tématu Hydrogensulfid sodný na Wikimedia Commons
Obrázky, zvuky či videa k tématu Hydrogensulfid sodný na Wikimedia Commons



