Fluorid jodičný
Fluorid jodičný je interhalogen se vzorcem IF5. Je to bezbarvá nebo nažloutlá kapalina. Poprvé byl připraven v roce 1891 Henrim Moissanem spalováním pevného jodu v plynném fluoru.[2] Tato exotermní reakce se stále využívá, jen za optimalizovaných podmínek.[3][4]
- I2 + 5 F2 → 2 IF5
| Fluorid jodičný | |
|---|---|
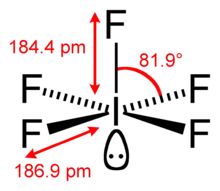
Struktura fluoridu jodičného | |

Kalotový model fluoridu jodičného | |
| Obecné | |
| Systematický název | Fluorid jodičný |
| Anglický název | Iodine pentafluoride |
| Německý název | Iodpentafluorid |
| Sumární vzorec | IF5 |
| Vzhled | bezbarvý nebo nažloutlá kapalina |
| Identifikace | |
| Registrační číslo CAS | 7783-66-6 |
| PubChem | 522683 |
| SMILES | FI(F)(F)(F)F |
| InChI | 1S/F5I/c1-6(2,3,4)5 |
| Vlastnosti | |
| Molární hmotnost | 221,89 g/mol |
| Teplota tání | 9,43 °C |
| Teplota varu | 97,85 °C |
| Hustota | 3,250 g·cm−3 (−80 °C) |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| NFPA 704 |  0
3
2
W
|
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Reakce
Fluorid jodičný je silné oxidační a fluorační činidlo. Reaguje prudce s vodou za vzniku kyseliny fluorovodíkové a jodičné:
- IF5 + 3 H2O → HIO3 + 5 HF
V kapalném stavu je slabě ionizovaný, stupeň ionizace lze zvýšit přídavkem fluoridu draselného. Z roztoku lze pak izolovat KIF6:[5]
- IF5 ↔ IF +
4 + IF -
6
Jako jediný interhalogen tvoří adukty s XeF2 a XeF4:[5]
- XeF2 + 2 IF5 ↔ XeF2·2IF5
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Iodine pentafluoride na anglické Wikipedii.
- Iodine pentafluoride. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- Annales de chimie et de physique. Gallica [online]. 1891 [cit. 2019-06-22]. Dostupné online. (FR)
- RUFF, Otto; KEIM, Rudolf. Das Jod-7-fluorid. Zeitschrift für anorganische und allgemeine Chemie. 1930-10-10, roč. 193, čís. 1, s. 176–186. Dostupné online [cit. 2019-06-22]. ISSN 0863-1786. DOI 10.1002/zaac.19301930117. (německy)
- RUFF, Otto; KEIM, Rudolf. Fluorierung von Verbindungen des Kohlenstoffs (Benzol und Tetrachlormethan mit Jod-5-fluorid, sowie Tetrachlormethan mit Fluor). Zeitschrift für anorganische und allgemeine Chemie. 1931-10-28, roč. 201, čís. 1, s. 245–258. Dostupné online [cit. 2019-06-22]. ISSN 0863-1786. DOI 10.1002/zaac.19312010122. (německy)
- GREENWOOD, NORMAN NEILL. Chemie prvků. Sv. 1.. 1. vyd. vyd. Praha: Informatorium 793 s., 1 příl s. ISBN 8085427389, ISBN 9788085427387. OCLC 320245801 S. 1027–1028.
Externí odkazy
 Obrázky, zvuky či videa k tématu Fluorid jodičný na Wikimedia Commons
Obrázky, zvuky či videa k tématu Fluorid jodičný na Wikimedia Commons
Portály: Chemie
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.





