Fluorid dusičný
Fluorid dusičný je teoretická sloučenina dusíku a fluoru, jejíž možná existence se odvozuje od pětimocných fluoridů dalších prvků, jako je například fluorid fosforečný (PF5) a fluorid amonný (NH +
4 F−). Podle teoretických modelů by jeho molekula měla mít strukturu kovalentní trigonální bipyramidy s grupou symetrie D3h nebo NF +
4 F−, což by byla iontová sloučenina.[1]
| Fluorid dusičný | |
|---|---|
| Obecné | |
| Systematický název | fluorid dusičný |
| Sumární vzorec | NF5 |
| Identifikace | |
| Registrační číslo CAS | 13706-13-3 |
| SMILES | F[N+](F)(F)F.[F-] (iontová forma) FN(F)(F)(F)F (kovalentní forma) |
| InChI | 1S/F4N.FH/c1-5(2,3)4;/h;1H/q+1;/p-1 |
| Vlastnosti | |
| Molární hmotnost | 109,00 g/mol |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Iontová sloučenina
V roce 1966 W. E. Tolberg poprvé připravil sloučeniny pětimocného dusíku s fluorem, šlo o soli tetrafluoramonného kationtu, konkrétně hexafluoroantimoničnan NF4SbF6 a hexafluoroarseničnan NF4AsF6.[2]
V roce 1971 oznámil C. T. Goetschel přípravu NF4BF4 a bílé pevné látky, kterou označil jako fluorid tetrafluoramonný (NF +
4 F−), reakcí fluoridu dusitého s fluorem při ostřelování elektrony s energií 3 MeV za teploty 77 K. Produkt se při teplotách nad 143 K rozkládal zpět na výchozí látky.[2] V teoretických studiích se rovněž ukázalo, že iontová forma by měla být náchylná k rozkladu na fluorid dusitý a fluor.[3]
Karl O. Christe připravil hexafluornikelnatan bis(tetrafluoramonný) (NF4)2NiF6[4] i obdobné manganaté, fluorurananové, chloristanové, fluorosíranové a N2F +
3 soli[5] a pokusil se získat NF4F metatezí NF4SbF6 pomocí CsF v HF při 20 °C; namísto toho však vznikl hydrogenfluorid tetrafluoramonný (NF4HF2·nHF), což je za pokojové teploty mlékovitá kapalina, která se při ochlazení mění na pastovitou hmotu a při −45 °C na bílou pevnou látku. Při opětovném zahřátí vytváří pěnu a uvolňuje F2, HF a NF3 jako plyny.[5]
I. J. Solomon se domníval, že připravil fluorid dusičný tepelným rozkladem NF4AsF6, ovšem výsledky tohoto experimentu se nepodařilo zopakovat.[6]
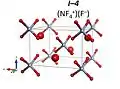
Dominik Kurzydłowski a Patryk Zaleski-Ejgierd předpověděli, že směs fluoru s fluoridem dusitým za tlaků 10 až 33 GPa vytváří NF +
4 F− s prostorovou grupou R3m; jednalo by se o příklad vysokotlaké oxidace. Nad 33 GPa by měla vznikat stabilní iontová sloučenina se vzorcem (NF +
4 )2NF −
6 F– a prostorovou grupou I4/m. Při tlacích vyšších než 151 GPa se má tato látka přeměňovat na NF +
4 NF −
6 s prostorovou grupou P4/n.[7]
NF5 v molekulární podobě není stabilní za žádného tlaku.
 NF +
NF +
4 F− R3m struktura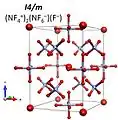 (NF +
(NF +
4 )2NF -
6 F− I4/m struktura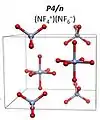 NF +
NF +
4 NF -
6 P4/n struktura
Molekula
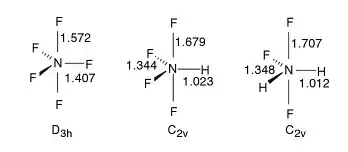
K tvorbě molekuly NF5 by bylo třeba, aby se na dusíkový atom navázalo pět atomů fluoru, přičemž k navázání nejkompaktnějším způsobem není dostatek místa, takže vazby musejí být delší. Podle výpočtů molekuly se NF5 z termodynamických důvodů rozpadají na NF4 a fluorové radikály za uvolnění energie 36 kJ/mol při energetické bariéře okolo 67–84 kJ/mol.[8]
Fluorid dusičný narušuje oktetové pravidlo, podle kterého jsou sloučeniny s osmi elektrony ve vnější slupce poměrně stabilní.[1]
Reference
V tomto článku byl použit překlad textu z článku Nitrogen pentafluoride na anglické Wikipedii.
- Errol G. Lewars. Modeling marvels: computational anticipation of novel molecules. [s.l.]: Springer, 2008-11-03. ISBN 978-1-4020-6972-7. DOI 10.1007/978-1-4020-6973-4_4. Kapitola Nitrogen Pentafluoride and Related Compounds, s. 53–67.
- C. T. Goetschel; V. A. Campanile; R. M. Curtis; K. R. Loos; C. D. Wagner; J. N. Wilson. Preparation and properties of perfluoroammonium tetrafluoroborate, NF +
4 BF −
4 , and possible synthesis of nitrogen pentafluoride. Inorganic Chemistry. 1972, s. 1696–1701. DOI 10.1021/ic50113a051. - Karl O. Christe; William W. Wilson. Nitrogen pentafluoride: covalent NF5 versus ionic NF4+F− and studies on the instability of the latter. Journal of the American Chemical Society. 1992, s. 9934–9936. DOI 10.1021/ja00051a027.
- Karl O. Christe. Synthesis and characterization of bis(tetrafluoroammonium) hexafluoronickelate. Inorganic Chemistry. 1977, s. 2238–2241. DOI 10.1021/ic50175a017.
- Karl O. Christe. Research Studies in NF4+ Salts [online]. Rockwell, 1980-05-23 [cit. 2012-02-23]. Dostupné online.
- Karl O. Christe; William W. Wilson; Gary J. Schrobilgen; Raman V. Chirakal; George A. Olah. On the existence of pentacoordinated nitrogen. Inorganic Chemistry. 1998, s. 789–790. DOI 10.1021/ic00278a009.
- Dominik Kurzydłowski; Patryk Zaleski-Ejgierd. Hexacoordinated nitrogen(V) stabilized by high pressure. Scientific Reports. 2016-11-03, s. 36049. DOI 10.1038/srep36049. PMID 27808104. Bibcode 2016NatSR...636049K.
- Holger F. Bettinger; Paul v. R. Schleyer; Henry F. Schaefer III. NF5 — Viable or Not?. Journal of the American Chemical Society. 1998-10-27, s. 11439–11448. DOI 10.1021/ja9813921.