Fluoren
Fluoren (též 9H-fluoren) je polycyklický aromatický uhlovodík se sumárním vzorcem C13H10, jehož molekula je formálně tvořena cyklopentanovým cyklem kondenzovaným s dvěma benzenovými jádry. Tato látka vytváří bílé krystaly s charakteristickým zápachem podobným jako u naftalenu, které jsou téměř nerozpustné ve vodě i mnoha organických rozpouštědlech.
| Fluoren | |
|---|---|
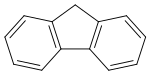
Strukturní vzorec | |
Tyčinkový model molekuly | |

Kalotový model molekuly | |
| Obecné | |
| Systematický název | 9H-fluoren |
| Ostatní názvy | tricyklo[7.4.0.02,7]trideka-2,4,6,9,11,13-hexaen |
| Sumární vzorec | C13H10 |
| Vzhled | bílé krystaly |
| Identifikace | |
| Registrační číslo CAS | 86-73-7 |
| EC-no (EINECS/ELINCS/NLP) | 201-695-5 |
| PubChem | 6853 |
| ChEBI | 28266 |
| SMILES | c1ccc2c3ccccc3Cc2c1 |
| InChI | 1S/C13H10/c1-3-7-12-10(5-1)9-11-6-2-4-8-13(11)12/h1-8H,9H2 |
| Číslo RTECS | LL5670000 |
| Vlastnosti | |
| Molární hmotnost | 166,22 g/mol |
| Teplota tání | 116 až 117 °C (389 až 390 K) |
| Teplota varu | 295 °C (568 K) |
| Hustota | 1,202 g/cm3 |
| Disociační konstanta pKa | 22,6 (v dimethylsulfoxidu) |
| Rozpustnost ve vodě | 1,992×10−4 g/100 ml |
| Měrná magnetická susceptibilita | −6,648×10−7 cm3g−1 |
| Bezpečnost | |
| [1] Varování[1] | |
| Teplota vzplanutí | 152 °C (425 K) |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Název tohoto uhlovodíku odráží jeho schopnost fialově fluoreskovat.
Pro komerční účely se fluoren získává z uhelného dehtu.
Příprava, struktura reaktivita
I když lze fluoren získat z uhelného dehtu, tak může být také vytvořen dehydrogenací difenylmethanu.[2] Rovněž jej lze připravit redukcí fluorenonu pomocí zinku.[3] Molekula fluorenu je téměř rovinná,[4] ovšem každý ze dvou benzenových kruhů je koplanární vzhledem k uhlíku 9 na prostředním cyklu.[5]
Kyselost
Uhlík na pozici 9 (C9) je slabě kyselý (pKa v dimethylsulfoxidu je 22,6[6] Deprotonací na tomto uhlíku vzniká fluorenylový anion C13H9−, který je aromatický a má výrazné oranžové zabarvení. Tento anion je nukleofilní a většina elektrofilů s ním reaguje tak, že se připojí na pozici 9. Při přečišťování fluorenu se využívá jeho kyselost a nízká rozpustnost sodíkového derivátu v uhlovodíkových rozpouštědlech.
Z C9 mohou být odtrženy oba protony; například lze získat 9,9-fluorenyldidraslík reakcí fluorenu s kovovým draslíkem ve vroucím dioxanu.[7]
Použití fluorenu jako ligandu
Fluoren a jeho deriváty mohou být deprotonovány za vzniku ligandů podobným cyklopentadienidům.
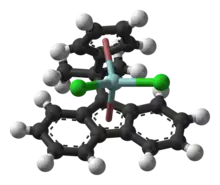
Použití
Fluoren je prekurzorem dalších fluorenových sloučenin a samotný nemá mnoho využití. Fluoren-9-karboxylová kyselina je výchozí látkou při výrobě některých léčiv. Oxidací fluorenu vzniká fluorenon, který je následně nitrován za vzniku řady užitečných derivátů. Fluorenylmethyloxykarbonylchlorid se používá k zavedení 9-fluorenylmethyl-karbamátové skupiny do aminů při syntéze peptidů.[2]
Polyfluorenové polymery (v nichž je C7 jedné molekuly fluorenu spojen s C2 další molekuly za odštěpení dvou vodíkových atomů) vedou elektrický proud a jsou elektroluminiscentní, díky čemuž je často zkoumáno jejich možné použití při výrobě luminoforů v organických světelných diodách.
Fluorenová barviva
Existuje několik fluorenových barviv, většina se jich vyrábí kondenzací aktivní methylenové skupiny s karbonylovými sloučeninami. K prekurzorům těchto barviv patří 2-aminofluoren, 3,6-bis(dimethylamino)fluoren a 2,7-dijodfluoren.[9]
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Fluorene na anglické Wikipedii.
- Fluorene. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- Karl Griesbaum, Arno Behr, Dieter Biedenkapp, Heinz-Werner Voges, Dorothea Garbe, Christian Paetz, Gerd Collin, Dieter Mayer, Hartmut Höke „Hydrocarbons“ in Ullmann's Encyclopedia of Industrial Chemistry 2002 Wiley-VCH, Weinheim. DOI:10.1002/14356007.a13_227
- Fittig, Rud. (1873), „Ueber einen neuen Kohlenwasserstoff aus dem Diphenylenketon“ Ber. Dtsch. Chem. Ges. volume 6, p. 187.DOI:10.1002/cber.18730060169
- D. M. Burns, John Iball (1954), Molecular Structure of Fluorene Nature volume 173, p. 635. DOI:10.1038/173635a0
- R. E. Gerkin, A. P. Lundstedt and W. J. Reppart (1984) Structure of fluorene, C13H10, at 159 K Acta Crystallographica, volume C40, pp. 1892–1894 DOI:10.1107/S0108270184009963
- F. G. Bordwell. Equilibrium acidities in dimethyl sulfoxide solution. Accounts of Chemical Research. 1988, s. 456–463. (anglicky)
- G. W. Scherf; R. K. Brown. Potassium Derivatives of Fluorene as Intermediates in the Preparation of C9-substituted Fluorenes. I. The Preparation of 9-fluorenyl Potassium and the Infrared Spectra of Fluorene and Some C9-substituted Fluorenes. Canadian Journal of Chemistry. 1960, s. 697. (anglicky)
- J. A. Ewen; R. L. Jones; A. Razavi; J.D. Ferrara. Syndiospecific Propylene Polymerizations with Group IVB Metallocenes. Journal of the American Chemical Society. 1988, s. 6255–6256. (anglicky)
- I. V. Kurdyukova; A. A. Ishchenko. Organic dyes based on fluorene and its derivatives. Russian Chemical Reviews. 2012, s. 258–290. (anglicky)

