Difluormethan
Difluormethan, také nazývaný HFC-32 nebo R-32, je organická sloučenina, difluorderivát methanu. Jeho vzorec je CH2F2.
| Difluormethan | |
|---|---|
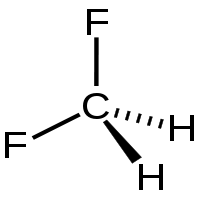
Strukturní vzorec | |

Model molekuly | |
| Obecné | |
| Systematický název | Difluormethan |
| Ostatní názvy | Methylendifluorid, methylenfluorid, HFC-32, R-32, FC-32 |
| Anglický název | Difluoromethane |
| Sumární vzorec | CH2F2 |
| Vzhled | bezbarvý plyn |
| Identifikace | |
| Registrační číslo CAS | 75-10-5 |
| PubChem | 6345 |
| ChEBI | 47855 |
| SMILES | FCF |
| InChI | 1S/CH2F2/c2-1-3/h1H2 |
| Číslo RTECS | PA8537500 |
| Vlastnosti | |
| Molární hmotnost | 52,023 g/mol |
| Teplota tání | −136 °C (137 K) |
| Teplota varu | −52 °C (221 K) |
| Hustota | 1,1 g/cm3 |
| Rozpustnost ve vodě | nerozpustný |
| Tlak páry | 1518,92 kPa (21,1 °C) |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| R-věty | R11 |
| S-věty | S9 S16 S33 |
| Teplota vznícení | 648 °C (921 K) |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Použití
Difluormethan je chladivo, které nepoškozuje ozonovou vrstvu. Difluormethan smíchaný s pentafluorethanem v poměru 1:1 se označuje R-410A, což je běžná náhrada za freony v nových chladicích zařízeních, obzvláště v klimatizacích. Obdobná směs difluormethanu s 1,1,1,2-tetrafluorethanem se označuje R-407A. Difluormethan je mírně hořlavý.[2] I když není škodlivý pro ozonovou vrstvu, jeho potenciál globálního oteplování je ve 100letém horizontu 675krát větší než u oxidu uhličitého.[3]
Reference
V tomto článku byl použit překlad textu z článku Difluoromethane na anglické Wikipedii.
- Difluoromethane. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- 2009 ASHRAE Handbook
- May 2010 TEAP XXI/9 Task Force Report
Externí odkazy
 Obrázky, zvuky či videa k tématu Difluormethan na Wikimedia Commons
Obrázky, zvuky či videa k tématu Difluormethan na Wikimedia Commons
Portály: Chemie | Životní prostředí
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.


