Bakteriorodopsin
Bakteriorhodopsin je integrální membránový protein obsažený ve slanomilných archeích Halobacteria. Při nízkém obsahu kyslíku tyto organismy v membráně vytváří okolo 0,5 µm[1] široké purpurové nebo nachové oblasti, jejichž jedinou bílkovinnou složkou je právě bakteriorhodopsin.
Struktura
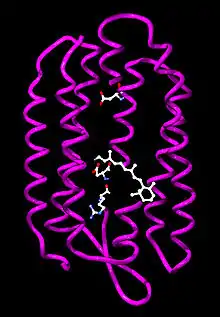
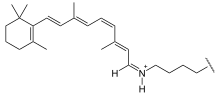
Bakteriorodopsin se skládá z 247 aminokyselin.[1] Obsažená prostetická skupina je kovalentně vázaný retinal, který patří mezi chromofory (světlo absorbující skupiny) a zodpovídá za purpurovou barvu bakteriorhodopsinu. Vazba mezi retinalem a lysinem-216 je Schiffova báze -CH=N(+)H-, podobně se váže i v rodopsinu (oční pigment).
Bílkovinná část obsahuje 7 α-helikálních hydrofobních nepolárních struktur, které jsou okolo 25 aminokyselin dlouhé.[1] Jelikož jsou téměř dokonale kolmé k rovině membrány, dobře interagují s hydrofobním vnitřkem fosfolipidové dvouvrstvy a jsou velmi stabilizované. Vnitřní skupiny jsou více polární a tvoří hydrofilní kanál, který umožňuje průchod vodíkovým kationtům. I jiné membránové pumpy a kanály mají podobné složení. N-koncová skupina (H3N+-) je umístěna vně buňky, šroubovice probíhají přes membránu střídavě dovnitř a ven, a proto je C-koncová skupina (-COO−) naopak uvnitř buňky.
Význam
Hlavní funkcí bakteriorhodopsinu je fotofosforylace:
- Pomocí světelné energie pumpuje přes membránu vodíkové kationty a vytváří rozdíl elektrického potenciálu.
- Vzniklý gradient (koncentrační spád) protonů je využit k syntéze energeticky bohaté sloučeniny ATP z ADP a anorganického fosfátu (fosforečnanu).
Nedostatek kyslíku pro získání energie oxidací živin buněčným dýcháním je tak kompenzován energií Slunce. Nejedná se však o fotosyntézu, neboť světelná energie se zde nevyužívá k syntéze sacharidů a podobných zásobních a stavebních sloučenin.
V klidovém stavu je Schiffova báze retinal-lysin protonovaná (RH+, navázaný vodíkový kation) a celá struktura je otevřena dovnitř membrány. Po exitaci absorpcí světla nastane konformační změna, což způsobí otočení R*H+ směrem ven z membrány (R* je excitovaná forma R). Dále se zvýší disociační konstanta (snížení pK) a dojde k uvolnění protonu vně membrány. Pumpa se posléze vrací do klidového stavu a R znovu směřuje dovnitř membrány. Relaxace způsobí pokles disociační konstanty (vzrůst pK) a dojde k navázání nového protonu z vnitřní strany membrány (RH+). Pumpa se opět nachází ve výchozím stavu a výsledkem jednoho cyklu je přenos jednoho protonu z vnitřní na vnější stranu membrány. Na syntézu jedné molekuly ATP je potřeba přenést 2-3 protony.[3]
Odkazy
Reference
- VOET, D.; VOETOVÁ, J. Biochemie. 1. čes. vyd. Praha: Victoria Publishing, 1995. ISBN 80-85605-44-9. S. 313–314.
- Oxford dictionary of biochemistry and molecular biology; revised edition. Příprava vydání A D Smith. [s.l.]: The General editors, 1997. Dostupné online. ISBN 0-19-850673-2.
- VOET, D.; VOETOVÁ, J. Biochemie. 1. čes. vyd. Praha: Victoria Publishing, 1995. ISBN 80-85605-44-9. S. 615–616.