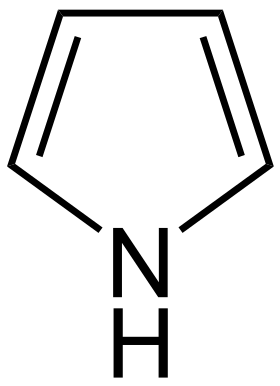
Pyrrol
Pyrrol (systematicky azol) je bezbarvá kapalina, nepříjemně páchnoucí, ve vodě nerozpustná, toxická. Vyskytuje se v černouhelném dehtu, v produktech suché destilace kostí, rohoviny. Je stavební jednotkou řady přírodních biologických významných látek, především tzv. tetrapyrrolových barviv (např. chlorofyl, hemoglobin, bilirubin) jejichž základem je porfin – tvořený čtyřmi pyrrolovými kruhy spojenými methinovými můstky. Pyrrol snadno podléhá oxidaci (vzdušným kyslíkem, laboratorně např. chloridem železitým), čímž vznikají reaktivní kation-radikály, či dikationty pyrrolu. Vznikem těchto elektrofilních molekul a jejich vzájemnou interakcí dochází k polymeraci pyrrolu, čímž vzniká makromolekulární sloučenina polypyrrol.
| Pyrrol | |
|---|---|
 | |
| Obecné | |
| Systematický název | azol |
| Sumární vzorec | C₄H₅N |
| Identifikace | |
| Registrační číslo CAS | 109-97-7 |
| Vlastnosti | |
| Molární hmotnost | 67,042 Da |
| Bezpečnost | |
| [1] Varování[1] | |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Významné deriváty pyrolu
Pyrrol sám se přirozeně nevyskytuje, ale mnoho z jeho derivátů se nachází v různých kofaktorech a přírodních produktech.[2]
- Prolin a hydroxyprolin – jsou součástí bílkovin
- Indol – krystalická látka s příjemnou vůni, je obsažena v květech jasmínu a v citrusech, je základem řady alkaloidů, součást hormonů, barviv, aminokyseliny tryptofan. (INDIGO-derivát indolu, což je modré barvivo, získávané již ve středověku z rostlin, dnes se vyrábí synteticky.)
Biochemicky významnými deriváty pyrrolu jsou cyklické tetrapyrroly (červený hem, zelený chlorofyl, růţový kyanokobalamin). Základní strukturou hemu je cyklický tetrapyrrol porfin, ve kterém jsou čtyři pyrrolová jádra spojena čtyřmi methinovými skupinami =CH v polohách 2 a 5 (polohách ). Deriváty porfinu, které mají navázány v -polohách různé substituenty, se nazývají porfyriny. Porfin a porfyriny představují planární, dokonale konjugované systémy dvojných vazeb a proto jsou výrazně zbarvené.[3]
Historie
Pyrrol byl poprvé objeven F. F. Rungem v roce 1834 jako složka černouhelného dehtu. V roce 1857 byl izolován z pyrolyzátu kosti. Jeho název pochází z řeckého pyrrhos ( πυρρός , „načervenalý, ohnivý“), z reakce používané k jeho detekci – červené barvy, kterou dodává dřevu, když je navlhčen kyselinou chlorovodíkovou.[2]
Příprava
Pyrrol se průmyslově připravuje zpracováním furanu amoniakem v přítomnosti pevných kyselých katalyzátorů , jako je SiO 2 a Al 2 O 3 . Pyrrol může být také vytvořen katalytickou dehydrogenací pyrrolidinu.[2]
Paal-Knorr Pyrolová syntéza
Paal-Knorrova pyrolová syntéza je kondenzací 1,4-dikarbonylové sloučeniny s přebytkem primárního aminu nebo amoniaku za vzniku pyrrolu.[4]
Reakce může být provedena za neutrálních nebo slabě kyselých podmínek. Přidání slabé kyseliny, jako je kyselina octová, urychluje reakci, ale použití aminových/amonných hydrochloridových solí nebo reakce při pH < 3 vedou k furanům jako hlavním produktům.
Reaktivita
Vzhledem ke svému aromatickému charakteru se pyrrol obtížně hydrogenuje. Jeho reaktivita je podobná reaktivitě benzenu a anilinu v tom, že se snadno alkyluje a acyluje. Za kyselých podmínek pyrroly snadno polymerují , a proto mnoho elektrofilních činidel, která se používají v chemii benzenu, nelze na pyrroly použít. Naproti tomu substituované pyrroly (včetně chráněných pyrrolů) byly použity v široké škále transformací.[2]
Reakce s kyselinami
Pyrrol účinkem anorganických kyselin při nízké teplotě protonizuje.[5]
Komerční použití
Polypyrrol má určitou komerční hodnotu. N -Methylpyrrol je prekurzorem N -methylpyrrolkarboxylové kyseliny, stavebního kamene ve farmaceutické chemii. Pyrroly se také nacházejí v několika drogách, včetně atorvastatinu , ketorolaku a sunitinibu . Pyrroly se používají jako světlostálé červené, šarlatové a karmínové pigmenty.[2]
Reference
- Pyrrole. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- Pyrrole. [s.l.]: [s.n.] Dostupné online. (anglicky) Page Version ID: 1027380999.
- 17 Heterocyklické sloučeniny [online]. Dostupné online.
- Paal-Knorr Pyrrole Synthesis. www.organic-chemistry.org [online]. [cit. 2022-02-18]. Dostupné online.
- Paal-Knorr Pyrrole Synthesis [online]. Dostupné online.
