Amonný kation
Amonium je víceatomový kationt s chemickým vzorcem NH +
4 , vzniká protonací amoniaku (NH3). Název tohoto iontu je taktéž součástí názvů protonovaných substituovaných aminů a kvartérních amoniových sloučenin (NR +
4 ), u nichž se namísto jednoho či více vodíkových atomů nachází organické funkční skupiny (ve vzorci označené jako R).
| Amonný kation | |
|---|---|

Strukturní vzorec | |

Kuličkový model molekuly | |

Kalotový model molekuly | |
| Obecné | |
| Systematický název | |
| Ostatní názvy | amonium |
| Anglický název | ammonium |
| Sumární vzorec | NH + 4 |
| Identifikace | |
| Registrační číslo CAS | 14798-03-9 |
| PubChem | 16741146 |
| SMILES | [NH4+] |
| InChI | 1S/H3N/h1H3/p+1 |
| Vlastnosti | |
| Molární hmotnost | 18,04 g/mol |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Acidobazické vlastnosti
Amonný kation vzniká reakcí amoniaku s Brønstedovou–Lowryho kyselinou (donorem protonů):
- H+ + NH3 → NH +
4
Tento kation je mírně kyselý, reaguje s Brønstedovými zásadami, přičemž vznikají opět nenabité molekuly amoniaku:
- NH +
4 + B− → HB + NH3
Reakcí koncentrovaných roztoků amonných solí se silnými zásadami tak lze připravit amoniak. Při rozpouštění amoniaku ve vodě se malá část jeho molekul přeměňuje na amonné kationty:
- H2O + NH3 ⇌ OH− + NH +
4
Míra přeměny amoniaku na amonné kationty závisí na pH roztoku. Při nízkém pH se rovnováha posouvá doprava: na ionty se přemění více molekul amoniaku. Při vysokém pH (tedy nízké koncentraci oxoniových kationtů) je rovnováha posunuta více doleva: hydroxidové anionty absorbují protony z amonných kationtů a mění je na molekuly amoniaku.
K tvorbě amooných sloučenin může docházet i v parách amoniaku, například při kontaktu par amoniaku a chlorovodíku vzniká bílý oblak chloridu amonného.
Přeměnu amonného iontu na amoniak lze usnadnit přidáním silné zásady.
Amonné soli
Amonný kation je součástí mnoha solí jako jsou uhličitan amonný, chlorid amonný a dusičnan amonný. Většina jednodušších amonných solí je velmi dobře rozpustná ve vodě; výjimku tvoří hexachloroplatnan amonný, jehož vznik byl dříve využíván k důkazu amonných kationtů. Dusičnan amonný a obzvláště chlorečnan amonný jsou silně výbušné, při jejich výbuchu působí amoniak jako redukční činidlo.
Amonné ionty mohou vytvořit amalgám. Jeden z nich lze připravit elektrolýzou roztoků amonných solí za použití rtuťové katody.[2] Tento amalgám se rozkládá za uvolnění amoniaku a vodíku.[3]
Struktura
Volný elektronový pár atomu dusíku vytváří vazbu s protonem (H+). Všechny čtyři vazby N-H jsou tedy ekvivalentní, jedná se o polární kovalentní vazby. Iont má tvar čtyřstěnu s atomem dusíku uprostřed a vodíkovými atomy ve vrcholech a je isoelektronový s methanem a boranem. Jeho poloměr je 175 pm, tedy podobný jako u cesného kationtu, který má poloměr 183 pm.
Organické sloučeniny s amonným kationtem
Vodíkový atom v amonném kationtu může být nahrazen alkylovou nebo jinou organickou skupinou za vzniku substituovaného amonného iontu (amoniový ion, systematický název je aminiový ion). Podle počtu navázaných skupin může být tento ion primární, sekundární, terciární nebo kvartérní; s výjimkou kvaternárních iontů jde o slabé kyseliny.
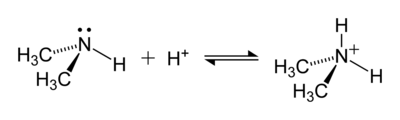
Příkladem reakce, při níž se vytváří takový kation je reakce dimethylaminu s kyselinou za vzniku dimethylaminiového kationtu, (CH3)2NH +
2 :
Kvartérní amoniové kationty mají na dusíkový atom navázány čtyři organické skupiny, na dusík není navázán žádný vodík. Tyto kationty, jako například tetrabutylamoniový kation, se někdy využívají k nahrazení sodných nebo draselných iontů za účelem navýšení rozpustnosti příslušného aniontu v organických rozpouštědlech. Primární, sekundární a terciární amoniové soli mají stejné využití, nejsou však tak lipofilní; používají se též jako katalyzátory fázového přenosu nebo jako tenzidy.
Zvláštní skupinou organických amonných solí jsou deriváty aminových radikálových kationtů, R3N+• jako například hexachloroantimonan tris(4-bromofenyl)amonný.
Kovové amonium
Amonný kation má velmi podobné vlastnosti jako kationty těžších alkalických kovů. Předpokládá se, že se amonium bude za velmi vysokých tlaků, například uvnitř obřích planet, jako jsou Uran a Neptun chovat jako kov (ionty NH +
4 obklopené volnými elektrony).[4][5]
Za běžných podmínek se amonium nevyskytuje jako čistý kov, ovšem se rtutí vytváří amalgámy.[6]
Odkazy
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu ammonium na Wikimedia Commons
Obrázky, zvuky či videa k tématu ammonium na Wikimedia Commons
Reference
V tomto článku byl použit překlad textu z článku Ammonium na anglické Wikipedii.
- Ammonium ion. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- Pseudo-binary compounds. www.hull.ac.uk [online]. [cit. 2018-08-04]. Dostupné v archivu pořízeném dne 2020-07-27.
- VIAS Encyclopedia. Ammonium Salts. [s.l.]: [s.n.] Dostupné online. (anglicky)
- STEVENSON, D. J. Does metallic ammonium exist?. Nature. Nature Publishing Group, November 20, 1975, s. 222–223. Dostupné online [cit. January 13, 2012]. DOI 10.1038/258222a0. Bibcode 1975Natur.258..222S. (anglicky)
- BERNAL, M. J. M.; MASSEY, H. S. W. Metallic Ammonium. Monthly Notices of the Royal Astronomical Society. Wiley-Blackwell for the Royal Astronomical Society, February 3, 1954, s. 172–179. Dostupné online [cit. January 13, 2012]. DOI 10.1093/mnras/114.2.172. Bibcode 1954MNRAS.114..172B. (anglicky)
- REEDY, J.H. Lecture demonstration of ammonium amalgam. Journal of Chemical Education. October 1, 1929, s. 1767. Dostupné online [cit. October 28, 2015]. DOI 10.1021/ed006p1767. Bibcode 1929JChEd...6.1767R. (anglicky)