Amid draselný
Amid draselný (KNH2) je chemická sloučenina draslíku s dusíkem a vodíkem (patří mezi amidy alkalických kovů). Molekula této sloučeniny je podobná molekule amoniaku, pouze jeden atom vodíku je nahrazen atomem draslíku.
| Amid draselný | |
|---|---|
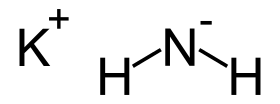
strukturní vzorec | |
| Obecné | |
| Systematický název | Amid draselný |
| Anglický název | Potassium amide |
| Německý název | Kaliumamid |
| Sumární vzorec | KNH2 |
| Vzhled | podle čistoty od šedobílých[1] přes žluté až po hnědé krystaly/amorfní |
| Identifikace | |
| Registrační číslo CAS | 17242-52-3 |
| EC-no (EINECS/ELINCS/NLP) | 241-275-9 |
| PubChem | 87015 |
| UN kód | |
| SMILES | [NH2-].[K+] |
| InChI | 1S/H2N.K/h1H2;/q-1;+1 |
| Vlastnosti | |
| Molární hmotnost | 55,12 g/mol |
| Teplota tání | 338 °C[2], 611 K, 640 °F |
| Hustota | 1 570 kg/m3[2] |
| Struktura | |
| Krystalová struktura | jednoklonná |
| Koordinační geometrie | P 21/m |
| Bezpečnost | |
| NFPA 704 |  2
3
3
W
|
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Vlastnosti
Amid draselný je hygroskopický, vytváří, podle stupně čistoty, šedobílé[1][2], žluté až hnědé jednoklonné krystaly až amorfní prášek. Zapáchá po amoniaku. Nebezpečně reaguje s vodou:
Vlivem vzdušné vlhkosti se krystaly roztékají a posléze rozkládají podle výše uvedené rovnice[2].
Při zahřívání se rozkládá:
Reaguje bouřlivě s neokysličujícími kyselinami za vzniku příslušných solí (draselné a amonné), např.:
nebo s okysličujícími kyselinami za vzniku (zde) azidu draselného, dusičnanu draselného a vody:
Příprava
Amid draselný může být připraven reakcí draslíku s plynným amoniakem:
nebo reakcí hydridu draselného s amoniakem:
nebo reakcí oxidu draselného s kapalným amoniakem:
V roce 1808 jej objevili Joseph Louis Gay-Lussac a Louis Jacques Thénard[3].
Použití
Amid draselný se používá jako silná zásada v organické syntéze pro nukleofilní substituce, polymerizace a podobně[4].
Bezpečnost
Amid draselný reaguje s vodou za vzniku amoniaku a hydroxidu draselného a hoří za vzniku peroxidu draselného, oxidu dusičitého a vody:
KNH2 + H2O → NH3 + KOH
2 KNH2 + 4 O2 → K2O2 + 2 NO2 + 2 H2O.
Podobné sloučeniny
Reference
V tomto článku byly použity překlady textů z článků カリウムアミド na japonské Wikipedii a Амид калия na ruské Wikipedii.
- Alkalimetals: MSDS Archivováno 4. 3. 2016 na Wayback Machine (PDF; 27 kB)
- D'ANS, Jean; LAX, Ellen. Taschenbuch für Chemiker und Physiker. [s.l.]: Springer, 2007. 1463 s. Dostupné online. ISBN 978-3540600350. S. 510. (německy)
- Sächsische Akademie der Wissenschaften. Chronologie der Naturwissenschaften. [s.l.]: [s.n.], 2002. 1258 s. Dostupné online. ISBN 978-3-8171-1610-2. S. 364. (německy)
- LAUTENSCHLÄGER, Karl-Heinz; SCHRÖTER, Werner; WANNINGER, Andrea. Taschenbuch der Chemie. [s.l.]: [s.n.], 2007. 890 s. Dostupné v archivu pořízeném dne 2014-05-02. ISBN 978-3-8171-1760-4. S. 286. (německy)