Staphylococcus aureus
Staphylococcus aureus (ľudovo zlatý stafylokok(us) alebo stafylokok(us) zlatý) je grampozitívna fakultatívne anaeróbna baktéria guľatého tvaru. Je to bežný člen mikrobioty tela, často sa nachádzajúci v horných dýchacích cestách a na koži. Zvyčajne sa správa ako komenzálny organizmus, no v niektorých prípadoch sa môže stať oportunistickým patogénom a spôsobovať infekcie kože, dýchacieho systému a otravu jedlom. Patogénne kmene produkujú virulenčné faktory (napr. toxíny) a na povrchu bunky exprimujú proteíny, ktoré viažu a inaktivujú protilátky. Celosvetovým problémom v medicíne je vývoj kmeňov rezistentným voči antibiotikám, napr. meticilín-rezistentný S. aureus. Napriek výskumu doteraz nebola schválená žiadna vakcína.
| Staphylococcus aureus | |
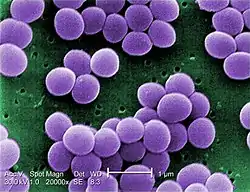 Staphylococcus aureus cez elektrónový mikroskop | |
| Vedecká klasifikácia | |
|---|---|
| Vedecký názov | |
| Staphylococcus aureus Rosenbach, 1884 | |
| Vedecká klasifikácia prevažne podľa tohto článku |
Odhadom 20-30% populácie sú dlhodobí nosiči S. aureus ako prirodzenej zložky mikrobioty kože, nosnej dutiny[1][2][3] a ženského pohlavného traktu.[4][5] S.aureus môže spôsobovať širokú škálu chorôb, od miernych kožných infekcií (vyrážka,[6] impetigo, vredy, abscesy) až po život ohrozujúce stavy (pneumónia, meningitída,osteomyelitída, endokartitída, syndróm toxického šoku, bakterémia a sepsa). Je jednou z piatich najčastejších príčin infekcií získaných v nemocnici a častou príčinou infekcií rán po operáciách.
Mikrobiológia
S.aureus je fakultatívne anaeróbna, grampozitívna kokovitá baktéria. Je nepohyblivá a netvorí spóry.[7] Tvorí veľké, kruhovité, zlato-žlté kolónie. Keď je kultivovaná na krvnom agare, je pozorovateľná hemolytická aktivita.[8]
Úloha v chorobách
S.aureus je zvyčajne komenzálna baktéria asymptomaticky kolonizujúca okolo 30% populácie, niekedy však môže spôsobovať choroby. Je jednou z najčastejších príčin bakterémie a infekčnej endokartitídy, okrem toho spôsobuje rôzne infekcie kože a mäkkých tkanív, hlavne keď sú porušené mukózne bariéry.[9]
Infekcie spôsobené S. aureus sa prenášajú kontaktom s hnisom z infikovaných rán, kontaktom s kožou infikovaného človeka, používaním rovnakých objektov (uteráky, posteľná bielizeň, oblečenie, pomôcky na cvičenie...). Výmena kĺbov prináša riziko septickej artritídy, stafylokokovej endokartitídy a pneumónie.[10]
Kožné infekcie
Kožné infekcie sú najčastejšou infekciou spôsobenou S. aureus. Prejavuje sa rôznymi spôsobmi, od vredov, folikulitídy, impetigo až po viac závažné invazívne infekcie mäkkých tkanív.
Infekcie S. aureus sa často prejavujú u ľudí trpiacich atopickou dermatitídou. Baktéria preniká cez porušenú kožnú bariéru pacientov a spúšťa tvorbu cytokínov a nástup symptómov.[11] Liečba antibiotikami orálnym podaním v tomto prípade neprináša pacientom žiadny benefit, avšak kombinácia antibiotík, ktoré sa aplikujú priamo na kožu, v spojení s kortikosteroidmi zlepšuje stav.[12]
Infekcie kostí a kĺbov
S. aureus je zodpovedný za väčšinu infekcií kostí a kĺbov a môže mať tri formy: osteomyelitída, septická artritída, alebo infekcia nasledujúca po výmene kĺbu.[13]
Bakterémia
Prítomnosť tejto baktérie v krvi je všeobecne spojená s poškodením kože alebo mukóznych povrchov po operácii, poranení, alebo po použití katétrov, dialýzy, injekčných striekačiek. Môže infikovať rôzne orgány a bez antibiotickej liečby je úmrtnosť na úrovni 80%. S liečbou sa pohybuje od 15% do 50% v závislosti na veku a stave pacienta a rezistencii voči antibiotikám u konkrétneho kmeňa S. aureus.[13]
Infekcie z lekárskych implantátov
S. aureus často tvorí biofilmy na implantátoch spolu s Candida albicans. Práve tá pravdepodobne pomáha pri penetrácii tkaniva.[14] S viacdruhovými biofilmami sa spája aj vyššia mortalita.[15]
Biofilmy S. aureus môžu byť nájdené na ortopedických, srdcových a kozmetických implantátoch, a katétroch. Ich povrchy sa v tele pokryjú hostiteľskými proteínmi, ktoré poskytujú povrch na prichytenie baktérií a formovanie biofilmov. Infikovaný implantát sa musí vymeniť, pretože biofilm sa nedá odstrániť antibiotikami.[16][17]
Prirodzená imunita
Imunitná odpoveď v koži
Za fyzikálne a biochemické bariéry kože sú zodpovedné keratinocyty spolu s produktami potu, lipidmi a antimikrobiálnymi peptidmi. Epidermis je formovaná keratinocytmi v rôznych štádiách vývoja, Langerhansovými bunkami a T lymfocytmi. Dermis obsahuje extracelulárnu matrix (kolagén, elastín, spojivové tkanivo). Ich vlákna poskytujú podpornú štruktúru pre cievy, fibroblasty, kožné rezidentné makrofágy, dermálne dendritické bunky, žírne bunky, T a B lymfocyty, plazmatické bunky a NK bunky. Všetky tieto bunky sú v koži bohato zastúpené a zapojené v kontrolovaní infekcie S. aureus.
Keratinocyty sú typicky prvé bunky, ktoré sa stretnú s patogénom a s patogénnymi molekulárnymi vzormi, ktoré sú rozoznávané receptormi TLR, NLR a scavenger receptormi. Ich signalizácia vyvoláva sekréciu cytokínov (IL-1, IL-17, IL-22, IFNγ, TNFα), chemokínov, antimikrobiálnych peptidov a NO syntázy. Do miesta sú atrahované neutrofily a monocyty, a spolu s rezidentnými makrofágmi rýchlo reagujú na baktériu, a ďalej stimulujú produkciu cytokínov a fagocytózu.
Kožné makrofágy fagocytujú a zabíjajú S. aureus prostredníctvom kyslíkových a dusíkových radikálov a animikrobiálnych peptidov. Okrem toho produkujú chemoatraktanty pre neutrofily a čistia miesto infekcie od mŕtvych buniek, čo tiež prispieva k prekonaniu infekcie.
Keď sa do miesta zápalu dostanú neutrofily, v snahe kontrolovať rast S. aureus ho fagocytujú, tvoria antimikrobiálne peptidy a NETs (neutrophil extracellular traps) – štruktúry bohaté na DNA, ktoré limitujú rozširovanie baktérie. Neutrofily však žijú krátko a ľahko podstupujú apoptózu, preto musia byť z miesta infekcie odstránené. S. aureus tvorí toxíny, ktoré urýchľujú smrť neutrofilov nekrózou. To spôsobí uvoľnenie molekúl spojených so signálom nebezpečenstva (IL-33, IL-1α, HGMB1, ATP), ktoré posilnia zápalovú reakciu v mieste infekcie.[18]
Adaptívna imunita
Hlavnú úlohu v obrane organizmu v rámci prirodzenej imunity hrajú neutrofily. Práve im bola venovaná veľká pozornosť. Avšak rozsiahle mechanizmy sprostredkované protilátkami a T lymfocytmi naznačujú, že adaptívna imunita má významný vplyv na citlivosť hostiteľa voči infekcii S. aureus.
Imunitná odpoveď proti S. aureus zahŕňa aktiváciu prirodzenej a adaptívnej imunity. Prirodzená imunita je rapídne aktivovaná rozoznaním nešpecifických patogénnych vzorov spojených s mikrobiálnou infekciou. Vo výsledku sú aktivované fagocyty (makrofágy, neutrofily). Neutrofily sú kľúčové komponenty akútnej odpovede proti S. aureus. Odpoveď adaptívnej imunity začína neskôr počas infekcie, po prezentácii bakteriálnych antigénov a v prítomnosti priaznivého cytokínového prostredia tvoreného bunkami prirodzenej imunity. Protilátky a T lymfocyty majú priamy efekt proti baktérii, ale taktiež zosilňujú aktivitu buniek prirodzenej imunity.
Mechanizmy úniku pred humorálnou odpoveďou
S. aureus vyvinul mechanizmy úniku pred protilátkovou odpoveďou B lymfocytov. Konkrétne proteíny SpA (staphylococcal Protein A) a Sbi (second immunoglobulin-binding protein)[19] sú virulenčné faktory, ktoré viažu imunoglobulíny. SpA je povrchový proteín zakotvený v cytoplazmatickej membráne, ktorý viaže Fc časť IgG. Táto orientácia IgG znemožňuje aktiváciu komplementu a opsonizáciu nasledovanú fagocytózou. SpA v sekretovanej forme je superantigén – viaže F(ab)2 časť receptoru B lymfocytov vedúcu k ich proliferácii a smrti.[20] Sbi, zakotvený v cytoplazmatickej membráne alebo sekretovaný, viaže Fc časť IgG alebo solubilný komplementový faktor C3.[21]
S. aureus je extracelulárny patogén, ale dokáže sa vyhnúť humorálnej odpovedi vstupom do buniek ako fakultatívny intracelulárny organizmus. Vstupom do neutrofilov sa vyhne zničeniu a dokáže v nich aj rásť,[22] alebo prečkáva v epiteliálnych bunkách.
Rola T lymfocytov
Zatiaľ čo úloha CD8+ T lymfocytov je zabíjať intracelulárne patogény a ich jednoznačná úloha nebola zaznamenaná, naivné CD4+ T lymfocyty sú polarizované na základe cytokínového prostredia do podskupín, ktorých efekty sa líšia. Hoci nedávnejšie popísané podskupiny T lymfocytov (γδ T lymfocyty, innate lymphoid cells (ILC), NK T lymfocyty) prispievajú hlavne k prirodzenej imunite v mukózach, nedávne správy naznačujú možnosť γδ T lymfocytov prispievať za určitých okolností k pamäti imunitného systému.[23]
Th1 lymfocyty
Aktivácia naivných CD4+ T lymfocytov v prítomnosti IL-12 vedie k tvorbe Th1 efektorových buniek. Ich hlavný produkt je IFNγ. Ten aktivuje fagocyty (makrofágy, neutrofily) k zabíjaniu intracelulárnych patogénov.[24]
V kontexte infekcie S. aureus môžu mať Th1 lymfocyty a IFNγ pozitívny aj negatívny efekt – sprostredkúvajú chemokínmi navodenú atrakciu neutrofilov, ale to paradoxne viedlo k zvýšeniu bakteriálnej záťaže, pravdepodobne kvôli schopnosti S. aureus perzistovať v neutrofiloch.[25][26]
Výsledný efekt Th1 buniek závisí na spôsobe infekcie, celkovom stave organizmu, úrovne indukcie a antigénnych cieľoch.[27]
Th2 lymfocyty
Aktivácia naivných CD4+ T lymfocytov v prítomnosti IL-4 vedie k tvorbe Th2 buniek. Produkujú hlavne IL-4, IL-5 a IL-13. Th2 bunky hrajú úlohu v boji proti extracelulárnym parazitom, ich odstránení a obnove tkaniva.[28] Pre stafylokokové ochorenie má osobitný význam atopická dermatitída charakterizovaná nadprodukciou cytokínov Th2 odpovede.[29] Tie prispievajú k problému priepustnosti bariér a iným znakom atopickej dermatitídy, a naopak, peptidoglykán a lipoteichová kyselina – súčasti bunkovej steny S. aureus, spolu s inými sekretovanými toxínmi aktivujú Th2 bunky a podporujú zápalové prostredie v koži pacientov.[27]
Th17 lymfocyty
Táto skupina T lymfocytov produkuje hlavne IL-17 a IL-22, ktoré posilňujú bariérové a antimikrobiálne funkcie epitelov, atrahujú neutrofily. Úlohu týchto lymfocytov naznačujú prípady spontánneho vývoja mukóznych infekcií a vyššej citlivosti voči infekciám kĺbov spôsobených S. aureus zapríčinené deficitom IL-17.[27]
Regulačné T lymfocyty
Tieto lymfocyty majú imunosupresívne funkcie sprostredkované kontaktom alebo cytokínmi. S. aureus môže indukovať regulačné T lymfocyty, ktoré znižujú efektorové funkcie T lymfocytov počas perzistujúcich infekcií.[30] Zvýšené počty regulačných T lymfocytov môžu tiež prispievať k dysregulácii imunitného systému a tak zvyšovať citlivosť voči S. aureus.[31]
Referencie
- TONG, Steven Y. C.; DAVIS, Joshua S.; EICHENBERGER, Emily. Staphylococcus aureus Infections: Epidemiology, Pathophysiology, Clinical Manifestations, and Management. Clinical Microbiology Reviews, 2015-7, roč. 28, čís. 3, s. 603–661. PMID: 26016486 PMCID: PMC4451395. Dostupné online [cit. 2020-06-27]. ISSN 0893-8512. DOI: 10.1128/CMR.00134-14.
- KLUYTMANS, J; VAN BELKUM, A; VERBRUGH, H. Nasal carriage of Staphylococcus aureus: epidemiology, underlying mechanisms, and associated risks.. Clinical Microbiology Reviews, 1997-07, roč. 10, čís. 3, s. 505–520. PMID: 9227864 PMCID: PMC172932. Dostupné online [cit. 2020-06-27]. ISSN 0893-8512.
- COLE, Alexander M.; TAHK, Samuel; OREN, Ami. Determinants of Staphylococcus aureus Nasal Carriage. Clinical and Diagnostic Laboratory Immunology, 2001-11, roč. 8, čís. 6, s. 1064–1069. PMID: 11687441 PMCID: PMC96227. Dostupné online [cit. 2020-06-27]. ISSN 1071-412X. DOI: 10.1128/CDLI.8.6.1064 – 1069.2001.
- SENOK, Abiola C.; VERSTRAELEN, Hans; TEMMERMAN, Marleen. Probiotics for the treatment of bacterial vaginosis. The Cochrane Database of Systematic Reviews, 2009-10-07, čís. 4, s. CD006289. PMID: 19821358. Dostupné online [cit. 2020-06-27]. ISSN 1469-493X. DOI: 10.1002/14651858.CD006289.pub2.
- Williams gynecology. New York : McGraw-Hill Medical, 2012. (2nd ed.) Dostupné online. ISBN 978-0-07-171672-7.
- Staphylococcal Infections [online]. medlineplus.gov, [cit. 2020-06-27]. Dostupné online.
- GRACE, Delia; FETSCH, Alexandra. Staphylococcus aureus. [s.l.] : Elsevier, 2018. Dostupné online. ISBN 978-0-12-809671-0. S. 3–10.
- Sherris medical microbiology : an introduction to infectious diseases. New York : McGraw-Hill, 2004. (4th ed.) Dostupné online. ISBN 0-8385-8529-9.
- TONG, Steven Y. C.; DAVIS, Joshua S.; EICHENBERGER, Emily. Staphylococcus aureus infections: epidemiology, pathophysiology, clinical manifestations, and management. Clinical Microbiology Reviews, 2015-07, roč. 28, čís. 3, s. 603–661. PMID: 26016486 PMCID: PMC4451395. Dostupné online [cit. 2020-06-27]. ISSN 1098-6618. DOI: 10.1128/CMR.00134-14.
- KUEHNERT, Matthew J.; HILL, Holly A.; KUPRONIS, Benjamin A.. Methicillin-resistant-Staphylococcus aureus hospitalizations, United States. Emerging Infectious Diseases, 2005-06, roč. 11, čís. 6, s. 868–872. PMID: 15963281 PMCID: PMC3367609. Dostupné online [cit. 2020-06-27]. ISSN 1080-6040. DOI: 10.3201/eid1106.040831.
- NAKATSUJI, Teruaki; CHEN, Tiffany H.; TWO, Aimee M.. Staphylococcus aureus exploits epidermal barrier defects in atopic dermatitis to trigger cytokine expression. The Journal of investigative dermatology, 2016-11, roč. 136, čís. 11, s. 2192–2200. PMID: 27381887 PMCID: PMC5103312. Dostupné online [cit. 2020-06-27]. ISSN 0022-202X. DOI: 10.1016/j.jid.2016.05.127.
- HON, Kam Lun; WANG, Shuxin Susan; LEE, Kenneth K. C.. Combined antibiotic/corticosteroid cream in the empirical treatment of moderate to severe eczema: friend or foe?. Journal of drugs in dermatology: JDD, 2012-07, roč. 11, čís. 7, s. 861–864. PMID: 22777230. Dostupné online [cit. 2020-06-27]. ISSN 1545-9616.
- RASMUSSEN, Rasmus V.; FOWLER, Vance G.; SKOV, Robert. Future challenges and treatment of Staphylococcus aureus bacteremia with emphasis on MRSA. Future microbiology, 2011-1, roč. 6, čís. 1, s. 43–56. PMID: 21162635 PMCID: PMC3031962. Dostupné online [cit. 2020-06-27]. ISSN 1746-0913. DOI: 10.2217/fmb.10.155.
- SCHLECHT, Lisa Marie; PETERS, Brian M.; KROM, Bastiaan P.. Systemic Staphylococcus aureus infection mediated by Candida albicans hyphal invasion of mucosal tissue. Microbiology, 2015-1, roč. 161, čís. Pt 1, s. 168–181. PMID: 25332378 PMCID: PMC4274785. Dostupné online [cit. 2020-06-27]. ISSN 1350-0872. DOI: 10.1099/mic.0.083485-0.
- ZAGO, Chaiene Evelin; SILVA, Sónia; SANITÁ, Paula Volpato. Dynamics of Biofilm Formation and the Interaction between Candida albicans and Methicillin-Susceptible (MSSA) and -Resistant Staphylococcus aureus (MRSA). PLoS ONE, 2015-04-13, roč. 10, čís. 4. PMID: 25875834 PMCID: PMC4395328. Dostupné online [cit. 2020-06-27]. ISSN 1932-6203. DOI: 10.1371/journal.pone.0123206.
- NANDAKUMAR, Venkatesan; CHITTARANJAN, Samuel; KURIAN, Valikapathalil Mathew. Characteristics of bacterial biofilm associated with implant material in clinical practice. Polymer Journal, 2013-02, roč. 45, čís. 2, s. 137–152. Dostupné online [cit. 2020-06-27]. ISSN 1349-0540. DOI: 10.1038/pj.2012.130. (po anglicky)
- ARCHER, Nathan K; MAZAITIS, Mark J; COSTERTON, J William. Staphylococcus aureus biofilms. Virulence, 2011, roč. 2, čís. 5, s. 445–459. PMID: 21921685 PMCID: PMC3322633. Dostupné online [cit. 2020-06-27]. ISSN 2150-5594. DOI: 10.4161/viru.2.5.17724.
- BRANDT, Stephanie L.; PUTNAM, Nicole E.; CASSAT, James E.. Innate Immunity to Staphylococcus aureus: Evolving Paradigms in Soft Tissue and Invasive Infections. The Journal of Immunology, 2018-06-15, roč. 200, čís. 12, s. 3871–3880. PMID: 29866769. Dostupné online [cit. 2020-06-27]. ISSN 0022-1767. DOI: 10.4049/jimmunol.1701574. (po anglicky)
- SMITH, Emma Jane; VISAI, Livia; KERRIGAN, Steven W.. The Sbi Protein Is a Multifunctional Immune Evasion Factor of Staphylococcus aureus ▿. Infection and Immunity, 2011-9, roč. 79, čís. 9, s. 3801–3809. PMID: 21708997 PMCID: PMC3165492. Dostupné online [cit. 2020-06-27]. ISSN 0019-9567. DOI: 10.1128/IAI.05075-11.
- KOBAYASHI, Scott D.; DELEO, Frank R.. Staphylococcus aureus Protein A Promotes Immune Suppression. mBio, 2013-10-01, roč. 4, čís. 5. PMID: 24085782 PMCID: PMC3791897. Dostupné online [cit. 2020-06-27]. ISSN 2150-7511. DOI: 10.1128/mBio.00764-13.
- SMITH, Emma Jane; VISAI, Livia; KERRIGAN, Steven W.. The Sbi Protein Is a Multifunctional Immune Evasion Factor of Staphylococcus aureus ▿. Infection and Immunity, 2011-9, roč. 79, čís. 9, s. 3801–3809. PMID: 21708997 PMCID: PMC3165492. Dostupné online [cit. 2020-06-27]. ISSN 0019-9567. DOI: 10.1128/IAI.05075-11.
- VOYICH, Jovanka M.; BRAUGHTON, Kevin R.; STURDEVANT, Daniel E.. Insights into mechanisms used by Staphylococcus aureus to avoid destruction by human neutrophils. Journal of Immunology (Baltimore, Md.: 1950), 2005-09-15, roč. 175, čís. 6, s. 3907–3919. PMID: 16148137. Dostupné online [cit. 2020-06-27]. ISSN 0022-1767. DOI: 10.4049/jimmunol.175.6.3907.
- MURPHY, Alison G.; O’KEEFFE, Kate M.; LALOR, Stephen J.. Staphylococcus aureus infection of mice expands a population of memory γδ T cells that are protective against subsequent infection. Journal of immunology (Baltimore, Md. : 1950), 2014-04-15, roč. 192, čís. 8, s. 3697–3708. PMID: 24623128 PMCID: PMC3979672. Dostupné online [cit. 2020-06-27]. ISSN 0022-1767. DOI: 10.4049/jimmunol.1303420.
- KARAUZUM, Hatice; DATTA, Sandip K.. Adaptive immunity against Staphylococcus aureus. Current topics in microbiology and immunology, 2017, roč. 409, s. 419–439. PMID: 26919865 PMCID: PMC5534385. Dostupné online [cit. 2020-06-27]. ISSN 0070-217X. DOI: 10.1007/82_2016_1.
- MCLOUGHLIN, Rachel M.; LEE, Jean C.; KASPER, Dennis L.. IFN-gamma regulated chemokine production determines the outcome of Staphylococcus aureus infection. Journal of Immunology (Baltimore, Md.: 1950), 2008-07-15, roč. 181, čís. 2, s. 1323–1332. PMID: 18606687. Dostupné online [cit. 2020-06-27]. ISSN 1550-6606. DOI: 10.4049/jimmunol.181.2.1323.
- MCLOUGHLIN, Rachel M.; SOLINGA, Robert M.; RICH, Jeremy. CD4+ T cells and CXC chemokines modulate the pathogenesis of Staphylococcus aureus wound infections. Proceedings of the National Academy of Sciences of the United States of America, 2006-07-05, roč. 103, čís. 27, s. 10408–10413. PMID: 16801559 PMCID: PMC1502471. Dostupné online [cit. 2020-06-27]. ISSN 0027-8424. DOI: 10.1073/pnas.0508961103.
- KARAUZUM, Hatice; DATTA, Sandip K.. Adaptive immunity against Staphylococcus aureus. Current topics in microbiology and immunology, 2017, roč. 409, s. 419–439. PMID: 26919865 PMCID: PMC5534385. Dostupné online [cit. 2020-06-27]. ISSN 0070-217X. DOI: 10.1007/82_2016_1.
- ALLEN, Judith E.; SUTHERLAND, Tara E.. Host protective roles of type 2 immunity: parasite killing and tissue repair, flip sides of the same coin. Seminars in Immunology, 2014-08, roč. 26, čís. 4, s. 329–340. PMID: 25028340 PMCID: PMC4179909. Dostupné online [cit. 2020-06-27]. ISSN 1096-3618. DOI: 10.1016/j.smim.2014.06.003.
- HAMID, Q.; BOGUNIEWICZ, M.; LEUNG, D. Y.. Differential in situ cytokine gene expression in acute versus chronic atopic dermatitis. The Journal of Clinical Investigation, 1994-08, roč. 94, čís. 2, s. 870–876. PMID: 8040343 PMCID: PMC296169. Dostupné online [cit. 2020-06-27]. ISSN 0021-9738. DOI: 10.1172/JCI117408.
- TEBARTZ, Christina; HORST, Sarah Anita; SPARWASSER, Tim. A major role for myeloid-derived suppressor cells and a minor role for regulatory T cells in immunosuppression during Staphylococcus aureus infection. Journal of Immunology (Baltimore, Md.: 1950), 2015-02-01, roč. 194, čís. 3, s. 1100–1111. PMID: 25548227. Dostupné online [cit. 2020-06-27]. ISSN 1550-6606. DOI: 10.4049/jimmunol.1400196.
- OU, Liang-Shiou; GOLEVA, Elena; HALL, Clifton. T regulatory cells in atopic dermatitis and subversion of their activity by superantigens. The Journal of Allergy and Clinical Immunology, 2004-04, roč. 113, čís. 4, s. 756–763. PMID: 15100684. Dostupné online [cit. 2020-06-27]. ISSN 0091-6749. DOI: 10.1016/j.jaci.2004.01.772.