Hexogén
Hexogén (1,3,5-cyklotrimetyléntrinitramín alebo 1,3,5-trinitro-1,3,5-triazocyklohexán; iné názvy: Cyklonit, RDX) je výkonná a citlivá trhavina, predovšetkým na vojenské a špeciálne použitie.
| Hexogén | |
| Chemický názov | cyklotrimetyléntrinitramín 1,3,5-cyklotrimetyléntrinitramín 1,3,5-trinitro-1,3,5-triazacyklohexán |
| Sumárny vzorec | |
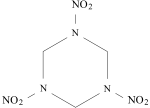 | |
| Teplota topenia | 203,5 °C
iný údaj 204,1 °C |
| Teplota varu | 234 °C
teplota výbuchu je nižšia ako teplota varu |
| Hustota | 1,82 g/cm³ |
| Detonačná rýchlosť | 8800 ms−1 pri 1,75 g/cm³ |
| Detonačný tlak | 349 960 bar
iný údaj 33,8 GPa |
| Výbuchová teplota | 3 380 °C |
| Pomerná sila k TNT | 180 % |
| Objem plynov | 910 dm3kg−1 |
| Pracovná schopnosť v olovenom valci | 470 cm³
iný údaj 450 – 520 cm³ |
| Pracovná schopnosť v balistickom mažiari | 32 cm (Tetryl = 40 a Pentrit = 28 cm) |
| Brizancia (podľa Hessa) | 16 – 18 mm pre 25 g
24 mm pre 50g (rozbíja olovený valček) |
| Brizancia (podľa Kasta) | flegmatizovaný 4,1 – 4,2 mm pri hustote 1,75 g/cm³ – 4,8 mm |
| Citlivosť na náraz (podľa Kasta) | 30 – 32 cm, 2 kg |
| Teplota výbuchu | 215 – 230 °C (rôzne metódy) |
| Iný názov | cyklonit, T-4, RDX (resarch departament explosives – trhavina výskumného oddelenia) E-Salz, W-Salz, KA-Salz – názov podľa procesu výroby |
Vlastnosti
Hexogén je chemicky alicyklický nitramín. V armáde sa najčastejšie používa medzinárodný názov Hexogén a Cyklonit (odvodené od cyklickej štruktúry a zároveň od cyklónu – tropickej búrky). V skratke sa uvádza ako RDX, v špecifickej munícii T4.
Hexogén tvorí biely jemne kryštalický prášok teploty topenia 203 °C, nerozpustný vo vode (rozpustnosť je pri 0 °C 0,01% a pri 100 °C 0,15%) a organických rozpúšťadlách (dobre rozpustný v acetóne – 6,81% pri 20 °C a 15,3% pri 58 °C, v ostatných rozpúšťadlách pod 1%).
Stykom s kyselinou sírovou s koncentráciou nad 70% sa úplne rozkladá na formaldehyd a ďalšie produkty. Vďaka tejto vlastnosti je nemožné použiť k preparácii nitračnú zmes obsahujúcu H2SO4.
Hexogén je stabilný, nereaguje s kovmi, nevytvára soli, a je pH neutrálny.
Použitie
Hexogén je veľmi brizantnou (trieštivou) trhavinou patriacou medzi najsilnejšie výbušniny. Svojím výkonom presahuje TNT (2,4,6-trinitrotoluén) o 80%. Používa sa na plnenie rozbušiek, počinových náloží, v kombinácii s veľkým množstvom iných výbušnín, najviac s TNT (Hexolity), hliníkom (Hexaly), dusičnanom amónnym (Ammatexy), v plastických trhavinách (Semtexy, kompozície C-4, Hexoplasty).
Zmesi s vysokým obsahom hexogénu sa používajú predovšetkým na plnenie bojových častí riadených striel, na výrobu kumulatívnych bojových častí a na plnenie nábojov pre malokalibrové automatické kanóny, teda tam, kde sa efektívne uplatní jeho veľký výkon a vysoká detonačná rýchlosť, alebo ho nie je možné nahradiť inou, lacnejšou trhavinou – hexogén je 15 až 20-krát drahší ako TNT.
Zaujímavé použitie je v systéme neelektrického odpalu NONEL. V plastovej trubičke malého priemeru je nanesená tenká vrstva čistého hexogénu (len desatiny gramu na meter dĺžky trubičky). Detonácia sa v trubičke šíri rýchlosťou len 2 000 m.s−1 (príklad detonácie v oblasti spodného medzného prierezu nálože). Ďalším netypickým použitím je jeho použitie ako streliviny v munícii s nízkou citlivosťou (LOVA).
Stabilita
Prednosťou je jeho veľká chemická stabilita, blížiaca sa aromatickým nitrolátkam. Často býva porovnávaný s pentritom, ale na rozdiel od neho je stabilnejší, má nižšiu citlivosť a pri vysokých hustotách i vyššiu brizanciu. Pri zahrievaní a vystavení dlhodobému tepelnému účinku je stabilnejší než pentrit aj tetryl. Stabilita hexogénu je teda vyššia než tetrylu a podľa niektorých odborných prác je dokonca podobná TNT.
Účinok svetla má len minimálny vplyv na zmenu vlastností. Pôsobením svetla obsahujúceho dochádza na povrchu k zmene farby z bielej na jasne žltú. Zmena farby súvisí so zmenou kryštálovej štruktúry, ale chemické a výbušné vlastnosti zostávajú bez zmeny.
S ohľadom na ostatné výbušniny je hexogén pomerne málo jedovatý, nevstrebáva sa pokožkou, len priamou inhaláciou. Príčinou malej jedovatosti je slabá rozpustnosť, ktorá spôsobuje, že sa nedostáva do krvi vo vysokej koncentrácii. Pri dlhodobom vdychovaní sa objavujú tonicko-klonické kŕče, ktoré nastávajú v 10-minútových intervaloch a po odstránení osoby zo zamoreného priestoru nemiznú. Príznaky otravy odznievajú až po 10 – 24 hodinách.
Výroba
Od objavenia hexogénu bolo popísaných približne 30 rôznych metód na jeho syntézu. Z tohoto počtu je 14 metód laboratórne uskutočniteľných, ale bez náležitých znalostí, dobrého laboratórneho vybavenia a presnej znalosti a dodržania postupov nie je žiadna z nich bezpečná.
Nitrolýza kyselinou dusičnou
Najstaršia a najjednoduchšia je metóda nitrolýzy bezvodou kyselinou dusičnou. Podľa tejto metódy sa k ochladenej bezvodej kyseline dusičnej prisypáva v malých dávkach urotropín (hexamín, hexametyléntetraamín), teplota sa intenzívnym chladením udržuje na 20 °C. Koncentrácia kyseliny dusičnej HNO3 je minimálne 98%.
Hlavná reakcia prebieha súčasne podľa dvoch rovníc:
(CH2)6N4 + 4 HNO3 → (CH2N.NO2)3 + 3 CH20 + NH4NO3 (vzniká formaldehyd a dusičnan amónny)
(CH2)6N4 + 6 HNO3 → (CH2N.NO2)3 + 6 H20 + 3 CO2 + 2 N2
Prebieha aj hydrolýza hexogénu na amoniak a formaldehyd a oxidácia formaldehydu kyselinou dusičnou. Okrem toho môžu prebiehať ďalšie vedľajšie reakcie, ktoré dávajú iné výbušné zlúčeniny.
Proces SH vypracoval Schnurra (Nemecko, 1937 – 38) – vychádza sa z hexamínu a kyseliny dusičnej.
Do koncentrovanej, 99% kyseliny dusičnej sa pridáva hexamín v pomere 1 diel hexamínu na 8 dielov HNO3 pri teplote nitrátoru 5−10 °C. Nitrácia v prvom nitrátore trvá hodinu, potom sa zmes prepúšťa do ďalších reaktorov, kde za dve hodiny teplota stúpa na 20 °C a reakcia dobehne do konca. Následne sa zmes prevedie do zrieďovačov s vodou aby koncentrácia HNO3 neklesla pod 50% a pri teplote 70 – 75 °C sa oxidom dusičitým odstránia nežiaduce prímesy kontrolovaným oxidačným procesom. Hexogén sa pritom vylúči vo forme kryštálov. Zmes sa postupne ochladí až na 20 °C a hexogén sa takmer úplne vylúči. Nasleduje premývanie vodou. Od stabilizácie dvojhodinovým varom pri tlaku 0,35 MPa a teplote 140 °C sa po výbuchu linky upustilo. Začala sa používať rekryštalizácia hexogénu z acetónu.
Proces K vypracoval Knöffler (Nemecko, 1943) – vychádza sa z hexamínu, kyseliny dusičnej a dusičnanu amónneho. Proces dáva lepšie výťažky ako proces SH a je bezpečnejší – reakcia môže prebiehať pri teplote až 80 °C, kým pri procese SH hrozí už pri teplote 25 °C výbuch. Reakcia prebieha podľa rovnice:
(CH2)6N4 + 2 NH4NO3 + 4 HNO3 → 2 (CH2N.NO2)3 + 6 H20
Do koncentrovanej, 99% kyseliny dusičnej sa pridáva hexamín v pomere 1 diel hexamínu na 8,6 dielov HNO3 a vypočítané množstvo NH4NO3 pri teplote 15 °C. Zmes sa prevedie do reaktoru a zahrieva na 80 °C po dobu 30 minút. Po prepustení do ďalšej nádoby sa zmes ochladí na 20 °C, pričom sa vylúči asi 90% hexogénu.
Vzniká problém, čo s odpadovou kyselinou, ktorá obsahuje ešte 10% hexogénu a dusičnan amónny, ktorý bráni jednoduchej recyklácii. Riešenie je v ochladení odpadovej kyseliny na −12 °C, pričom dusičnan amónny vykryštalizuje vo forme amóniumtrinitrátu (NH4NO3.2 HNO3) a použije sa na vstupe procesu. Odpadová kyselina sa ďalej spracuje, aby sa vylúčil i zvyšok hexogénu a použije na prípravu NH4NO3.
Proces W vypracoval Wolfram (1934) – vychádza sa z kyseliny sulfamínovej, formaldehydu a kyseliny dusičnej. Kyselina sulfamínová sa pripraví z oxidu sírového a amoniaku a prevedie na draselnú soľ. Tá sa kondenzuje s formaldehydom a vznikne metylénaminosulfónan draselný. Táto látka sa nitruje nitračnou zmesou pripravenou z 99% HNO3 a oxidu sírového. Vzniknutý hexogén sa sčasti hneď vylúči a sčasti zostáva v roztoku. Úplné vylúčenie sa zabezpečí zriedením reakčnej zmesi vodou. Hexogén sa premyje vodou do neutrálnej reakcie. Pôvodne sa rekryštalizoval z nitrobenzénu. Po výbuchu linky sa prešlo na rekryštalizáciu z acetónu. Metóda je menej rentabilná a po vojne sa prestala používať.
Proces E vypracoval Eble (v Nemecku 1935 – 1938) a nezávisle od neho Ross a Schieseler (v USA 1940) – vychádza z paraformaldehydu, acetanhydridu a dusičnanu amónneho. Hlavná reakcia prebieha podľa vzorca:
3 CH2O + 3 NH3NO2 + 6 (CH3CO)2O → (CH2N.NO2)3 + 12 CH3COOH
Prednosťou je, že tvorba hexogénu prebieha bez nitrácie, nevýhodou je použitie relatívne drahého acetanhydridu. Ako katalyzátor sa používa fluorid boritý, ktorý uľahčuje začiatok reakcie a obmedzuje vedľajšie reakcie, pri ktorých vzniká oktogén a hlavne mnoho lineárnych nitramínov. Pripravený hexogén má nižšiu teplotu tavenia (190 – 195 °C), čo naznačuje, že je pomerne nečistý a musí sa ďalej čistiť. Väčšina lineárnych nitramínov je dobre rozpustná v kyseline octovej a tak stačí hexogén odsať z odpadovej kyseliny. Lineárne nitramíny je možné vracať do reakcie, pretože mnoho z nich tvorí za prítomnosti dusičnanu amónneho a acetanhydridu hexogén.
V priemyslových podmienkach je výťažnosť 60 – 65%, v laboratórnych podmienkach je možné dosiahnuť výťažok až 80% (počítané na formaldehyd). Kyselina octová sa z reakčnej zmesi oddestiluje alebo extrahuje etylacetátom a používa sa na výrobu acetanhydridu.
Proces KA vypracoval Knöffler (Nemecko 1943), ide vlastne o kombináciu procesu K a procesu E. Postup vychádza z dinitrátu hexamínu, amóniumdinitrátu a acetanhydridu. Dinitrát hexamínu sa pripraví pôsobením 50% HNO3 na hexamín pri teplote pod 15 °C. Hlavná reakcia prebieha podľa rovnice:
(CH2)6N4.HNO3 + 2 (NH4NO3.HNO3) + 6 (CH3CO)2O → 2 (CH2N.NO2)3 + 12 CH3COOH
V reaktore sa pripraví zmes časti acetanhydridu a filtrátu z predošlej šarže, teplota sa udržuje na 40 – 50 °C. Postupne sa po menších dávkach pridáva striedavo amóniumdinitrát a dinitrát hexamínu. Potom sa pridá druhá dávka acetanhydridu a opäť v menších dávkach sa pridáva amóniumdinitrát a dinitrát hexamínu. Po poslednej dávke sa teplota zvýši na 60 °C a udržuje pol hodinu. Celý proces trvá cca 4 hodiny. Potom sa zmes ochladí na 20 °C a vykryštalizovaný hexogén sa odsaje. Výťažok je cca 70%. Vzniknutý hexogén má teplotu topenia 185 – 190 °C a je znečistený prímesami. Časť filtrátu sa vracia späť priamo, väčšia časť sa destiluje. Po destilácii kyseliny octovej zostáva v destilačnom zvyšku silne znečistený hexogén s teplotou tavenia menej než 160 °C, ktorý je možné tiež vrátiť späť na začiatok reakcie a zvýšiť tak výťažnosť.
Bachmannov proces – vypracoval ho Bachmann (USA 1941) a ide o variant procesu KA.
Rekryštalizácia hexogénu z acetónu – Pripravený roztok hexogénu sa nasype do 8 – 10 násobného množstva acetónu zohriateho na 50 °C. Po rozpustení hexogénu sa roztok prefiltruje cez tkaninu a prevedie do väčšej nádoby. Tu sa počas 5 minút privedie 12 – 15 násobné množstvo vody (počítané na hexogén) a teplota sa udržuje na 25 °C. Pri riedení acetónu vodou sa vylučujú pomerne veľké kryštáliky hexogénu (cca 0,1 mm), ktoré sa odfiltrujú na vákuovom filtri. Acetón sa ešte raz dôkladne filtruje a potom destiluje v rektifikačnej kolóne. Zachytávajú sa aj pary acetónu počas celého procesu.
Rekryštalizovaný hexogén sa flegmatizuje voskom. Flegmatizačný aparát s miešadlom sa naplní horúcou vodou (80 – 88 °C) v množstve 5 násobku hmotnosti hexogénu a zapne sa miešadlo, mieša sa intenzívne. Pridá sa rekryštalizovaný hexogén. Po rozmiešaní sa pridáva 5 – 10 % montánneho vosku s farbivom (množstvo vosku a teplota sa volí podľa potrebného stupňa flegmatizácie; pre nižší stupeň flegmatizácie s menším množstvom vosku je potrebná vyššia teplota vody). Po pridaní vosku a dôkladnom zamiešaní sa začne obsah flegmatizátoru pomaly chladiť. Celá operácia trvá asi 2 hodiny. Flegmatizovaný hexogén sa odfiltruje vo vákuovom filtri, suší a preosieva. Farbivo vo vosku odlišuje flegmatizovaný a neflegmatizovaný hexogén.
V súčasnosti sa na flegmatizáciu hexogénu používajú aj rôzne plastické hmoty, ktoré majú výrazne lepšie vlastnosti ako vosk. Takéto trhaviny sú často označované skratkou PBX a číslom. Skratka PBX znamená plastic bonded explosive.
Zdroje
- Project-X vs. Detonator
- Urbaňski: Chémia a technológia výbušnín III
| Chemický portál |