Alfa-helix
α-helix (iné názvy: α-skrutkovica, alfa-helix, alfa-skrutkovica) je jeden z dvoch základných typov priestorového usporiadania bielkovín (konkrétne ich tzv. sekundárnej štruktúry).[1] Druhým je beta-skladaný list. Alfa-helix má tvar pravotočivej skrutkovice, pri pohľade zhora tvorí skrutkovicu bielkovinná kostra, zatiaľ čo aminokyselinové zvyšky smerujú von. Medzi jednotlivými poschodiami skrutkovice vznikajú vodíkové mostíky (a to konkrétne medzi C=O skupinou a N–H skupinou o štyri aminokyseliny ďalej).[1] Typickými aminokyselinami vyskytujúcimi sa v alfa-helixe je hlavne alanín, kyselina glutámová, leucín a metionín. Pokiaľ sa niekde vyskytne prolín, spravidla spôsobí ohyb celej skrutkovice.[2]
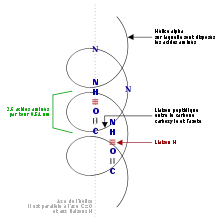
Všetky donory vodíkových mostíkov sú orientované jedným smerom a akceptory smerom opačným, helix je teda vlastne slabým elektrickým dipólom. Týchto interakcií využíva k skladaniu štruktúr vyššieho radu (terciárne štruktúry proteínov).
Parametre
Pre alfa-helix platia tieto parametre:[2]
- počet aminokyselín na jeden závit (otáčku) alfa-helixu: 3,6
- výška jedného závitu (merané pozdĺž osi skrutkovice): 0,54 nanometrov.
- vzdialenosť ekvivalentných (zodpovedajúcich si) atómov v kostre skrutkovice: 0,15 nanometrov.
Referencie
- ROBERT C. KING; WILLIAM D. STANSFIELD; PAMELA K. MULLIGAN. A Dictionary of Genetics, Seventh Edition. [s.l.] : Oxford University Press, 2006.
- Murray RK. et al., Harperova biochemie (2002); dvadsiate tretie vydanie (štvrté české vydanie)
Zdroj
Tento článok je čiastočný alebo úplný preklad článku Alfa-helix na českej Wikipédii.
| Chemický portál |