Tetrahydroxydibor
Tetrahydroxydibor je anorganická sloučenina používaná na přípravu boronových kyselin.[2]
| Tetrahydroxydibor | |
|---|---|
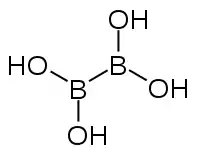
Strukturní vzorec | |
| Obecné | |
| Systematický název | tetrahydroxydiboran |
| Funkční vzorec | [B(OH)2]2 |
| Sumární vzorec | B2O4H4 |
| Vzhled | bílý prášek |
| Identifikace | |
| Registrační číslo CAS | 13675-18-8 |
| PubChem | 10986154 |
| ChEBI | 38289 |
| SMILES | B(B(O)O)(O)O |
| InChI | 1S/B2H4O4/c3-1(4)2(5)6/h3-6H |
| Vlastnosti | |
| Molární hmotnost | 89,65 g/mol |
| Teplota tání | 143 až 148 °C (416 až 421 K) |
| Hustota | 1,657 g/cm3 |
| Rozpustnost ve vodě | velmi dobře rozpustný |
| Rozpustnost v polárních rozpouštědlech |
rozpustný v ethanolu, dimethylformamidu, dimethylsulfoxidu a dimethylacetamidu |
| Bezpečnost | |
| [1] | |
| H-věty | H302 H315 H319 H335[1] |
| P-věty | P261 P264 P270 P271 P280 P301+312 P302+352 P304+312 P304+340 P305+351+338 P312 P321 P330 P332+313 P337+313 P362P403+233 P405 P501[1] |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Příprava
V roce 1931 byla popsána reakce chloridu boritého s alkoholy, kterou vznikal dimethoxychlorid boritý, B(OCH3)2Cl.[3]
Egon Wiberg a Wilhelm Ruschmann připravili tetrahydroxydibor redukcí této sloučeniny sodíkem a hydrolýzou vzniklého tetramethoxydiboru, B2(OCH3)4.[4]
Použitý methanol může být obnoven:
- BCl3 B(OCH3)2Cl B2(OCH3)4 B2(OH)4
Souhrnná rovnice vypadá takto 2 BCl3 + 2 Na + 4 H2O → B2(OH)4 + 2 NaCl + 4 HCl
Reakce
Při zahřátí nad 90 °C se tetrahydroxydibor dehydratuje na polymerní oxid. K úplnému odstranění vody je třeba teplota nad 220 °C.[5]
Tetrahydroxydibor je redukčním činidlem. Ve vodném roztoku se pomalu uvolňuje plynný vodík.[4]
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Tetrahydroxydiboron na anglické Wikipedii.
- https://pubchem.ncbi.nlm.nih.gov/compound/10986154
- Sarah Little; Jane Trice. Encyclopedia of Reagents for Organic Synthesis. [s.l.]: John Wiley & Sons, 2001. ISBN 9780470842898. DOI 10.1002/047084289x.rn01181. Kapitola Tetrahydroxydiboron.
- Egon Wiberg; Walther Sütterlin. Zur Kenntnis einiger Verbindungen vom Typus BCl3−n(OR)n. (Über alkoxyl-substituierte Borchloride). [s.l.]: [s.n.], 1931. DOI 10.1002/zaac.19312020102. S. 1–21.
- Egon Wiberg; Wilhelm Ruschmann. Über eine neue Borsäure (‚Unterborsäure’︁) der Formel H4B2O4 und ihre Ester. [s.l.]: [s.n.], 1937. DOI 10.1002/cber.19370700636. S. 1393–1402.
- Thomas Wartik; Eugene F. Apple. A New Modification of Boron Monoxide. [s.l.]: [s.n.], 1955. DOI 10.1021/ja01628a116. S. 6400–6401.
Externí odkazy
 Obrázky, zvuky či videa k tématu Tetrahydroxydibor na Wikimedia Commons
Obrázky, zvuky či videa k tématu Tetrahydroxydibor na Wikimedia Commons
