Stiban
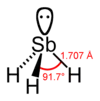
Stiban nebo antimonovodík, starší název stibin, je za normálních podmínek bezbarvý plyn pronikavého zápachu, trochu připomínajícího sulfan (sirovodík). Ve vodě je prakticky nerozpustný. Ochlazováním se mění na bezbarvou kapalinu a dále pak na bílou krystalickou látku, krystalující v ortorombické soustavě. Molekula stibanu má tvar trojbokého jehlanu, s atomem antimonu na vrcholu a s vodíkovými atomy v rozích podstavy tvaru rovnostranného trojúhelníku.
| Stiban | |
|---|---|
Strukturní vzorec stibanu | |

Model stibanu | |
| Obecné | |
| Systematický název | Stiban, hydrid antimonitý |
| Triviální název | Antimonovodík |
| Ostatní názvy | Stibin |
| Anglický název | Stibine |
| Německý název | Stiban |
| Sumární vzorec | SbH3 |
| Vzhled | Bezbarvý zapáchající plyn |
| Identifikace | |
| Registrační číslo CAS | 7803-52-3 |
| Vlastnosti | |
| Molární hmotnost | 124,774 g/mol |
| Teplota tání | −88,5 °C |
| Teplota varu | −17,1 °C |
| Hustota | 4,63 g/cm3 (pevná látka) 2,26 g/cm3 (kapalina, −25 °C) 5 48 kg/m3 (plyn) |
| Rozpustnost ve vodě | velmi málo |
| Rozpustnost v polárních rozpouštědlech |
dobře rozpustný v ethanolu a sirouhlíku |
| Rozpustnost v nepolárních rozpouštědlech |
nerozpustný |
| Relativní permitivita εr | 2,93 (−80 °C) |
| Tlak páry | 82,8 kPa (−23 °C) |
| Ionizační energie | 9,58 eV |
| Struktura | |
| Koordinační geometrie | trigonální pyramida |
| Dipólový moment | 0,4×10−30 C·m |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | 145,11 kJ/mol |
| Standardní molární entropie S° | 232,7 JK−1mol−1 |
| Standardní slučovací Gibbsova energie ΔGf° | 147,7 kJ/mol |
| Měrné teplo | 0,329 JK−1g−1 (konst. tlak, 25 °C) |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| R-věty | R12; R26 |
| S-věty | S1; S9; S16; S33; S36; S45 |
| NFPA 704 |  4
4
2
|
| Teplota vznícení | Ve směsi se vzduchem samovznítitelný |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Příprava
Připravuje se redukcí sloučenin trojmocného antimonu vodíkem ve stavu zrodu, např.
- SbCl3 + 6 H → SbH3 + 3 HCl,
nebo rozkladem antimonidu zinečnatého nebo hořečnatého působením kyseliny chlorovodíkové
- Sb2Zn3 + 6 HCl → 2 SbH3 + 3 ZnCl2, resp.
- Sb2Mg3 + 6 HCl → 2 SbH3 + 3 MgCl2.
Chemické reakce
Je nestabilní, pomalu se rozkládá na prvky již za laboratorní teploty
- 2 SbH3 → 2 Sb + 3 H2.
Při 200 °C je rozklad velmi rychlý, dekompozice je autokatalytická a může být až explozivní.
Snadno se oxiduje na oxid antimonitý a vodu,[2] zapálený hoří modrozelenavým plamenem:
- 2 SbH3 + 3 O2 → Sb2O3 + 3 H2O.
Organické deriváty
Stiban je základem organoantimonitých sloučenin. Nejjednoduššími jsou methylstiban CH3SbH2, dimethylstiban (CH3)2SbH a trimethylstiban (CH3)3Sb. Nemají však větší význam.
Využití
Stiban se používá v elektrotechnickém průmyslu při výrobě mikroelektronických součástek pro nanášení stopových množství antimonu pomocí chemické depozice z plynné fáze.
Bezpečnost
Stiban je hořlavý plyn, který může explodovat ve směsi se vzduchem. Je vysoce toxický.
Odkazy
Reference
- Stibine. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- GREENWOOD, NORMAN NEILL. Chemie prvků. Sv. 1.. 1. vyd. vyd. Praha: Informatorium 793 s., 1 příl s. ISBN 8085427389, ISBN 9788085427387. OCLC 320245801 S. 683.
Literatura
- VOHLÍDAL, JIŘÍ; ŠTULÍK, KAREL; JULÁK, ALOIS. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.

