Poločas přeměny
Poločas přeměny (obvykle označovaný T½) je doba, za kterou se přemění polovina celkového počtu atomárních jader ve vzorku. Pro konkrétní izotop je konstantní. Má hodnotu od zlomku sekundy až po milióny let. Často se používá i termín poločas rozpadu, ale ten je méně obecný, protože ne každá radioaktivní přeměna představuje rozpad (například vyzáření fotonu gama záření z excitovaného jádra).

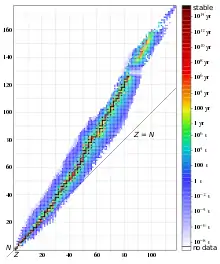
Pro konkrétní jádro nuklidu (určitého izotopu daného prvku) nelze v principu určit, kdy dojde k přeměně. Kvantová mechanika jako pravděpodobnostní teorie umožňuje stanovit pouze pravděpodobnost, že k přeměně dojde v daném časovém úseku, například v následujících 10 minutách. Tento pravděpodobnostní charakter prakticky znamená, že máme-li vzorek látky (obsahující jediný radioaktivní nuklid) běžné velikosti a tedy o velkém počtu atomů (ke srovnání Avogadrova konstanta), pak můžeme přesně vypočítat dobu, za jakou se přemění právě polovina přítomných jader.
Izotopy
Stabilita izotopu se určuje právě na základě poločasu přeměny. Stabilní izotopy ho mají nekonečný, jádra se samovolně nepřeměňují. Za stabilnější je považován izotop s větším poločasem přeměny, protože jeho nuklidy v průměru déle vydrží být tím, čím jsou.
V přírodní směsi daného chemického prvku jsou určitá procentuální zastoupení několika jeho izotopů. Například vodík v oceánské vodě obsahuje 99,9844 % protia (to jest atomy se samotným protonem v jádře) a 0,0156 % deuteria, takzvaného těžkého vodíku, který má v jádře navíc vázaný jeden neutron. Oba izotopy jsou zcela stabilní. Krom toho existuje izotop vodíku se třemi nukleony zvaný tritium, který se v přírodní směsi nevyskytuje, vyrábí se uměle. Tritium je radioaktivním zářičem β s poločasem přeměny 12,36 let. Některé chemické prvky vůbec nemají stabilní izotopy, například radon. Některé se vyskytují v přírodě jak ve formě stabilních izotopů, tak i nestabilních. Například uhlík v atmosférickém oxidu uhličitém obsahuje díky kosmickému záření stálý podíl radioaktivního izotopu C 14. Měření jeho procentuálního zastoupení v předmětech organického původu umožňuje určit jejich stáří díky známému poločasu přeměny (5715 let). Tento způsob měření stáří se nazývá radiokarbonová metoda datování.
Příklady
Příklady nejznámějších radioizotopů, řazeno dle poločasu přeměny.
| Prvek | Izotop | Poločas rozpadu |
|---|---|---|
| Beryllium | 8Be | 6,7×10−17 s[1] |
| Polonium | 212Po | 0,3 µs[1] |
| Thorium | 223Th | 0,9 sekundy[1] |
| Francium | 223Fr | 22 minut[1] |
| Síra | 35S | 87,5 dní[1] |
| Kobalt | 60Co | 5,27 let[2] |
| Tritium | 3H | 12,36 let[1] |
| Cesium | 137Cs | 30,17 let[2] |
| Radium | 226Ra | 1 622[1] / 1 602[2] let |
| Uhlík | 14C | 5 730 let[1][2] |
| Plutonium | 239Pu | 24 110[1] / 24 400[2] let |
| Uran | 235U | 710 milionů let[2] |
| Draslík | 40K | 1,26 miliardy let[2] |
| Uran | 238U | 4,468[1] / 4,51[2] miliard let |
| Thorium | 232Th | 14,05[1] / 13,9[2]miliard let |
| Bismut | 209Bi | cca 1,9×1019 let[1] |
Příbuzné veličiny
Obecněji definovanou veličinou stejného charakteru je střední doba života, obvykle značená . Pro exponenciální přeměnu lze souvislost s poločasem přeměny zapsat vztahem:
Odkazy
Reference
- Radioaktivita a jaderné reakce - Zákony radioaktivních přeměn [PDF online]. Gymnázium & SOŠPg Liberec Jeronýmova [cit. 2011-03-02]. Dostupné v archivu pořízeném dne 2011-07-18.
- ULLMANN, Vojtěch. Jaderná a radiační fyzika - Radionuklidy - Některé nejdůležitější radionuklidy [online]. Astro Nukl Fyzika [cit. 2011-03-02]. Dostupné online.
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu poločas přeměny na Wikimedia Commons
Obrázky, zvuky či videa k tématu poločas přeměny na Wikimedia Commons - Radioaktivita, studijní text Přírodovědecké fakulty Masarykovy univerzity
- Ionizující záření, Miniencyklopedie ČEZu