Pevný kyslík
Pevný kyslík vzniká za normálního tlaku při teplotách pod -218,79 °C (54,36 K). Je to, podobně jako kapalný kyslík, čirá látka s lehce namodralou barvou způsobenou absorpcí červeného záření (na rozdíl od barvy oblohy, která je způsobena Rayleighovým rozptylem).
Molekuly kyslíku přitahují pozornost díky vztahu mezi molekulárním magnetizmem a krystalovou strukturou, elektronovou strukturou a supravodivostí. Kyslík je jedinou jednoduchou, dvouatomovou molekulou (a jednou z mála molekul obecně), která vykazuje magnetický moment.[1] Díky tomuto je pevný kyslík mimořádně zajímavý, lze ho považovat za "spinově-řízený" krystal[1], který vykazuje neobvyklé magnetické chování.[2] Za velmi vysokých tlaků změní pevný kyslík své chování z izolantu na kovový stav[3] a za velmi nízkých teplot přejde do supravodivého stavu[4]. Výzkum struktury kyslíku započal ve dvacátých letech 20. století, a v současnosti známe šest odlišných krystalografických fází.[1]
Fázové přechody
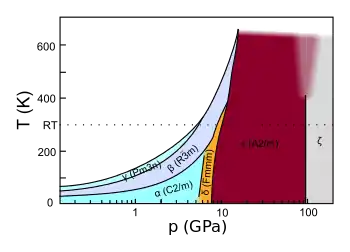
Známe celkem šest různých fází pevného kyslíku:[1][5]
- α-fáze: světle modrá - vzniká za atmosférického tlaku při teplotě nižší než -249,35 °C, monoklinická krystalová struktura.
- β-fáze: slabě modrá až růžová - vzniká za atmosférického tlaku při teplotě nižší než -229,35 °C, romboedrická krystalová struktura, (při laboratorní teplotě a vysokém tlaku se začíná transformovat na tetrakyslík).
- γ-fáze: slabě modrá - vzniká za atmosférického tlaku při teplotě nižší než -218.79 °C, krychlová krystalová struktura.
- δ-fáze: oranžová — vzniká za laboratorní teploty při tlaku 9 GPa
- ε-fáze: tmavě červená až černá — vzniká za laboratorní teploty při tlaku vyšším než 10 GPa
- ζ-fáze: kovová — vzniká při tlacích vyšších než 96 GPa
Je známo, že kyslík při přechodu do pevného skupenství za laboratorní teploty a při vysokém tlaku vytváří β-fázi, dalším zvyšováním tlaku přechází tato fáze na fázi δ při 9 GPa a ε při 10 GPa, tyto přechody jsou spojené se změnou barvy na růžovou, oranžovou, potom červenou (stabilní fáze oktakyslíku), a poté červená barva přechází se zvyšujícím se tlakem na černou. Tyto barevné změny jsou způsobeny zvětšováním molekulárních interakcí. Pokud na fázi ε působíme tlakem vyšším než 96 GPa přechází na ještě hustší modifikaci ζ.[5]
Červený kyslík
Jakmile tlak kyslíku při pokojové teplotě překročí 10 GPa, dojde k výrazným fázovým přeměnám na jiné alotropní modifikace. Tyto změny jsou doprovázeny výrazným snížením objemu[6] a barevnou změnou z modré na tmavě červenou.[7] Fáze ε byla objevena roku 1979, ale její struktura nebyla objasněna. Na základě infračervených spekter, byla v roce 1999 navržena struktura obsahující molekuly O4 v krystalové mřížce.[8] V roce 2006 byla provedena rentgenová strukturní analýza této fáze, díky níž bylo zjištěno, že je červený kyslík tvořen molekulami O8.[9]
[10] Taková struktura nebyla nikdy teoreticky předpovězena:[5] romboedrický klastr[11] O8 skládající se ze čtyř molekul O2.
 |  |
Ze všech fází pevného kyslíku je tato poměrně zajímavá: má tmavě červenou barvu, velmi silnou absorpci infračerveného záření a pod vlivem magnetického pole kolabuje.[1] Je stabilní ve velmi širokém rozmezí tlaků a stala se předmětem zkoumání v mnoha projektech z oblasti rentgenové strukturní analýzy a spektroskopie a také v mnoha teoretických studiích. Bylo zjištěno, že krystaluje v monoklinické C2/m soustavě a její absorpci v infračervené oblasti lze vysvětlit pomocí shlukování kyslíkových molekul do větších jednotek.
- Kapalný kyslík se využívá jako oxidovadlo v raketách, předpokládá se, že červený kyslík bude ještě silnější oxidovadlo, protože má vyšší hustotu energie.[12]
- Vědci předpokládají, že tato struktura silně ovlivní výzkum struktury prvků.[5]
- Tato fáze vzniká při teplotách nad 600 K a tlacích nad 17 GPa.[5]
- Při 11 GPa je vazebná délka uvnitř O8 klastru 0,234 nm a vzdálenost mezi klastry 0,266 nm (Pro srovnání, vazebná délka u molekuly kyslíku O2 je 0,120 nm).[5]
- Mechanismus vzniku klastru O8 zatím nebyl objasněn, ale předpokládá se, že velkou roli hraje přenos náboje mezi molekulami kyslíku nebo magnetický moment molekuly kyslíku.[5]
Kovový kyslík
ζ-fáze kyslíku vzniká stlačováním ε-kyslíku na tlak 96 GPa.[6] Poprvé byla připravena roku 1990 stlačením kyslíku na tlak 132 GPa.[3] ζ-fáze s kovovým klastrem[13] vykazuje nízkoteplotní supravodivost.[4][5]
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Solid oxygen na anglické Wikipedii.
- FREIMAN, Y. A., Jodl, H. J. Solid oxygen. Phys. Rep.. 2004, roč. 401, s. 1–228. DOI 10.1016/j.physrep.2004.06.002.
- GONCHARENKO, I. N., Makarova, O. L. & Ulivi, L. Direct determination of the magnetic structure of the delta phase of oxygen. Phys. Rev. Lett.. 2004, roč. 93, s. 055502. DOI 10.1103/PhysRevLett.93.055502.
- DESGRENIERS, S., Vohra, Y. K. & Ruoff, A. L. Optical response of very high density solid oxygen to 132 GPa. J. Phys. Chem.. 1990, roč. 94, s. 1117–1122. DOI 10.1021/j100366a020.
- SHIMIZU, K., Suhara, K., Ikumo, M., Eremets, M. I. & Amaya, K. Superconductivity in oxygen. Nature. 1998, roč. 393, s. 767–769. DOI 10.1038/31656.
- Solid Oxygen ε-Phase Crystal Structure Determined Along With The Discovery of a Red Oxygen O8 Cluster [online]. 2006-12-04 [cit. 2008-01-10]. Dostupné online.
- AKAHAMA, Yuichi, Haruki Kawamura, Daniel Häusermann, Michael Hanfland, and Osamu Shimomura. New High-Pressure Structural Transition of Oxygen at 96 GPa Associated with Metallization in a Molecular Solid. Physical Review Letters. June 1995, roč. 74, čís. 23, s. 4690–4694. Dostupné online. DOI 10.1103/PhysRevLett.74.4690.
- NICOL, Malcolm, K. R. Hirsch, and Wilfried B. Holzapfel. Oxygen Phase Equilibria near 298 K. Chemical Physics Letters. December 1979, roč. 68, čís. 1, s. 49–52. DOI 10.1016/0009-2614(79)80066-4.
- GORELLI, Federico A., Lorenzo Ulivi, Mario Santoro, and Roberto Bini. The ε Phase of Solid Oxygen: Evidence of an O4 Molecule Lattice. Physical Review Letters. November 1999, roč. 83, čís. 20, s. 4093–4096. Dostupné online. DOI 10.1103/PhysRevLett.83.4093.
- FUJIHISA, Hiroshi, Yuichi Akahama, Haruki Kawamura, Yasuo Ohishi, Osamu Shimomura, Hiroshi Yamawaki, Mami Sakashita, Yoshito Gotoh, Satoshi Takeya, and Kazumasa Honda. O8 Cluster Structure of the Epsilon Phase of Solid Oxygen. Physical Review Letters. 08. 2006, roč. 97, s. 085503. Dostupné online. DOI 10.1103/PhysRevLett.97.085503.
- LUNDEGAARD, Lars F., Gunnar Weck, Malcolm I. McMahon, Serge Desgreniers and Paul Loubeyre. Observation of an O8 molecular lattice in the phase of solid oxygen. Nature. 09. 2006, roč. 443, s. 201–204. Dostupné online. DOI 10.1038/nature05174.
- STEUDEL, Ralf. Dark-Red O8 Molecules in Solid Oxygen: Rhomboid Clusters, Not S8-Like Rings. Angewandte Chemie International Edition. 09. 2007, roč. 46, čís. 11, s. 1768–1771. Dostupné online. DOI 10.1002/anie.200604410.[nedostupný zdroj]
- BALL, Phillip. New form of oxygen found [online]. 2001-11-16 [cit. 2006-07-13]. Dostupné online.
- EDWARDS, Peter P., Friedrich Hensel. Metallic Oxygen. ChemPhysChem. 01. 2002, roč. 3, čís. 1, s. 53–56. Dostupné online. DOI 10.1002/1439-7641(20020118)3:1<53::AID-CPHC53>3.0.CO;2-2.[nedostupný zdroj]