Oxid antimonitý
Oxid antimonitý (chemický vzorec Sb4O6, někdy zkráceně jen Sb2O3) je nejdůležitější sloučeninou antimonu.
| Oxid antimonitý | |
|---|---|
 | |
| Obecné | |
| Systematický název | Oxid antimonitý |
| Anglický název | Antimony trioxide |
| Německý název | Antimon(III)-oxid |
| Sumární vzorec | Sb4O6 |
| Vzhled | Bílá práškovitá látka |
| Identifikace | |
| Registrační číslo CAS | 1309-64-4 |
| EC-no (EINECS/ELINCS/NLP) | 215-175-0 |
| Indexové číslo | 051-005-00-X |
| Vlastnosti | |
| Molární hmotnost | 291,52 g/mol |
| Teplota tání | 656 °C |
| Teplota varu | 1 426 °C |
| Teplota změny krystalové modifikace | 572 °C |
| Hustota | 5,19 g/cm3 (α-modifikace) 5,778 g/cm3 (β-modifikace) |
| Rozpustnost ve vodě | 1,4 mg/100 ml (30 °C) |
| Rozpustnost v polárních rozpouštědlech |
rozpustný v koncentrovaných kyselinách a zásadách |
| Relativní permitivita εr | 12,8 |
| Tlak páry | 13,3 hPa (660 °C) |
| Měrná magnetická susceptibilita | −2,978 Sm−1 |
| Struktura | |
| Krystalová struktura | krychlová (α-modifikace) kosočtverečná (β-modifikace) |
| Hrana krystalové mřížky | a=1 113 pm (α-modifikace) a=492 pm; b=1 246 pm; c=542 pm (β-modifikace) |
| Koordinační geometrie | pyramida |
| Dipólový moment | 0 C.m |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −709 kJ/mol (α-modifikace) |
| Entalpie tání ΔHt | 188 J/g |
| Entalpie varu ΔHv | 256 J/g |
| Standardní molární entropie S° | 133 J.K−1.mol−1 (α-modifikace) |
| Standardní slučovací Gibbsova energie ΔGf° | −626,5 kJ/mol (α-modifikace) −617,8 (β-modifikace) |
| Bezpečnost | |
| [1] Varování[1] | |
| R-věty | R40 |
| S-věty | S2, S22, S36/37 |
| NFPA 704 |  1
2
0
|
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Příprava
Oxid antimonitý lze připravit více způsoby:
- Spalováním elementárního antimonu na vzduchu:
4 Sb + 3 O2 → Sb4O6.
4 SbCl3 + 6 H2O → Sb4O6 + 12 HCl.
- Pražením minerálů antimonu (hlavní průmyslová metoda přípravy).
Chemické vlastnosti
Oxid antimonitý je amfoterní oxid. Lze ho přímo oxidovat na oxid antimoničný nebo jiné sloučeniny antimoničné. Také ho lze jednoduše redukovat na antimon.
Struktura
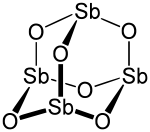
V pevném stavu se oxid antimonitý vyskytuje ve struktuře, která tvarem odpovídá struktuře adamantanu. Každý atom antimonu je vázán se třemi atomy kyslíku a ty následně s dalšími třemi atomy antimonu. Všechny atomy antimonu jsou tedy vzájemně provázány přes "kyslíkové můstky". Je proto vhodnější zapisovat vzorec oxidu jako Sb4O6 a nikoliv Sb2O3 i když tento zápis není chybně, ale nezachycuje plně strukturu sloučeniny.
V plynné fázi existuje tento oxid v dimerní formě Sb4O6, která je isostrukturní s oxidem fosforečným, tato forma je přítomna také v krystalické kubické formě. Monoklinická forma má lístkovou strukturu složenou z pyramidálních skupin {SbO3}, které sdílejí atom kyslíku.
Toxikologie
Oxid antimonitý je pouze slabě absorbován zažívací soustavou, hlavní cestou expozice je vdechování prachu. Vylučování antimonu z těla je pomalé, takže je nebezpečný z hlediska chronické toxicity. Akutní otravy nejsou časté.[zdroj?]
Reference
- Senarmontite. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
Literatura
- VOHLÍDAL, JIŘÍ; ŠTULÍK, KAREL; JULÁK, ALOIS. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
Externí odkazy
 Obrázky, zvuky či videa k tématu Oxid antimonitý na Wikimedia Commons
Obrázky, zvuky či videa k tématu Oxid antimonitý na Wikimedia Commons

