Myosatelitní buňka
Myosatelitové buňky, známé také jako satelitní buňky či svalové kmenové buňky, jsou malé nediferencované multipotentní buňky[1]. Satelitní buňky jsou kmenovými buňkami kosterní svaloviny a mohou vytvářet nové dceřiné buňky, které se mohou stát novými satelitními buňkami, nebo se diferencovat v buňky kosterního svalstva.[2] Jde miogenní prekurzory, které mají schopnost znovu vstoupit do buněčného cyklu a vytvářet nová svalová vlákna.[3] Nebo můžou poskytovat další jádra svalového vlákna (Myonuklei) mateřskému vláknu.[2] Satelitní buňky jsou naprosto klíčové pro regeneraci svalů.[3]
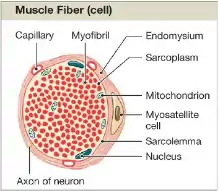
Satelitní buňky najdeme z vnější strany sarcolemy a pod bazální laminou svalového vlákna, kde mohou ležet v žlábku bud rovnoběžně nebo šikmo/příčně k ose vlákna.[4] Klidové satelitní buňky rozpoznáme s vyžitím elektronové mikroskopie, díky odlišnému umístění mezi bazální laminou a sarcolemou, velkým poměrem objemu jádra buňky k objemu cytoplazmy té buňky s několika organelami (malý počet ribozomů, endoplazmatické retikulum,mitochondrie, Golgiho aparát), malou velikostí jádra a velkým množství nukleárního heterochromatinu vzhledem k myonuklei. Naproti tomu aktivované satelitní buňky se vyznačují zvýšeným počtem kaveol a organel v cytoplazmě a také nižším množstvím heterochromatinu.[5]
Struktura
Genetické markery
Satelitní buňky vykazují řadu genetickým markerů, jako např. PAX 7 a PAX 3 (paired box proteins 3 and 7), které jsou nezbytné pro vývoj svalu. Buňky, u kterých nedochází k expresy těchto proteinů umírají, či končí nemyogenním osudem.[6] Dalšími markery, které najdeme na klidových i aktivovaných satelitních buňkách jsou molekuly adheze neurálních buněk-neural cell adhesion molecule (N-CAM / CD56 / Leu-19), což je glykoprotein nacházející se na buněčném povrchu. [5]
Existuje jen pár tkání, které si v dospělosti zachovali schopnost regenerace. Jednou z nich je kosterní svalovina, která k tomu využívá populaci klidových prekurzorů, satelitních buněk. Tyto buňky, bývají specificky definovány markery CD34,marker hematopoetické kmenové buňky a Myf5.[7] U aktivované satelitní buněk se postupně snižuje exprese markeru Pax7, což ztěžuje jejich identifikaci, a také u nich docházi k zvyšování exprese transkripčních faktorů helix-loop-helix MyoD a MRF4. Tyto myogení faktory jsou důležité pro vývoj svalů. Ztráta Myod1 nebo Myf5 neovlivní vývoj svalů, vzájemně se funkčně kompenzují, ale když dojde ke ztrátě obou těchto genů, následkem je úplné vymyzení svalové hmoty a myoblastů.[8]
Funkce
Regenerace svalů
Svalové satelitní buňky jsou nezbytné k regeneraci kosterního svalstva. [9] Klidové satelitní buňky lze aktivovat proliferací nebo diferenciací v reakci na vnější podnět. Mezi hlavní podněty patří zranění svalu a cvičení, které a jsou definované expresí proteinových markerů, konkrétně CD34þ, a7b1 integrinþ, Pax3þ a Pax7þ.[8]
Při zranění svalu dochazí ke ztrátě uspořádanosti svalových vláken a vzikají zde mezery, ve kterých najdeme poškozenou sarkolemu a klidové satelitní buňky.[10] Zranění svalu, tedy vede k uvolnění klidových satelitních buněk z pod bazální laminy. Satelitní buňky jsou aktivovány a opětovně vstupují do buněčného cyklu, tyto buňky, které nazývané "transit amplifying pool" se dále diferencují za vzniku nových svalových vláken. [1] Podobným procesem jako při vývoji svalových buněk plodu.[10]
Satelitní buňky májí nejen nezastupitelnou funkci pro svalovou regeneraci, ale neméně podstatné je i jejich klinické využití při léčbě smrtelných nemocí jako je svalová dystrofie.[11]
Oprava poškozené tkáně má čtyři fáze: degenerace, zánět, regenerace a fibróza. Dochází zde k napadání poškozené tkáně různými imunitními buňkami a následně probýhá oprava, růst a regenerace svalové tkáně. Což zahrnuje aktivace a proliferace satelitních buněk a jejich terminální diferenciace. Jednu z hlavních rolí při diferenciaci a proliferaci satelitních buněk hraje IGF-1, inzulinu podobný růstový faktor.
Při cvičení, nebo svalovém poškození dochází k velmi rychlé aktivaci a mechano růstového faktoru (MGF), což je autokrinní forma IGF-1.Toto naznačuje, že MGF hraje důležitou roli pro regenerační kapacitu stárnoucího kosterního svalu.[10][11][12]
Efekt cvičení
Reakce každého jedince na cvičení je odlišná, a to díky různým faktorům, mezi které patří např. genetika, věk, strava a intenzita cvičení.
U lidí může dojít ke zvýšení objemu satelitních buněk již po čtyřech dnech cvičení. A při dlouhodobém tréninku je jejich objem udržován na vyšší úrovni. Když dojde k ukončení pravidelného cvičení, objem satelitních buněk zůstane po nějakou dobu zachován, ale bez pravidelného cvičení začne objem satelitních buněk po určité době klesat.[5] [2]
Aktuální výzkum naznačuje, že NO a HGF / c-met jsou nezbytné pro aktivaci satelitních buněk. HGF se uvolňuje z extracelulární matrix, odkud putuje do svalů, kde se váže na onkogen c-met. Tato vazba v různých tkáních, včetně svalů indukuje buňky k proliferaci, či migraci. Zajímavé je, že přenos HGF z extracelulární matrix do svalů je závislí na oxidu dusnatém.
Také se ukázalo, že růstové faktory IGF-I a růstový faktor fibroblastů FGF neaktivují satelitní buňky, jak se dříve myslelo, ale spíše zvyšují jejich proliferaci.[13] Bylo prokázáno, že pravidelným cvičení docházi k zvyšování produkce IGF-I a xanthinu oxidáze a v kosterním svalu. IGF-1 má ve dvě izoformy: mechano růstový faktor (MGF) a IGF-IEa. MGF hraje důležito roli pro regenerační kapacitu stárnoucího svalu a navozuje a proliferaci. IGF-IEa je zodpovědný za diferenciaci proliferujících satelitních buněk.[12][14]
Bylo prokázáno, že i při indukci exogenního IGF-I přímo do kosterního svalu došlo ke zvýšení svalové hmoty, což ukazuje, že zvýšení množství IGF-I vede k růstu svalové hmoty. Ke zvýšení IGF-I mRNA dochází po cvičení u lidí, či protahování u zvířat. Jak již bylo řečeno cvičení může zvyšovat množství IGF-I , což má za následek zvýšenou syntézu myofibrilárních proteinů, aktivaci satelitních buněk a následnou hypertrofie myofibril.[15] Tyto výsledky ukazují, že lehký vytrvalostní trénink, může být velice nápomocný pro vyrovnání úbytku satelitních buněk, ke kterému dochází ve stáří.[5]
V roce 2004 byla provedena studie, jejíž cílem bylo prozkoumat modulaci obsahu satelitních buněk po 30 a 90 dnech zátěžového tréninku Tato studie byla proveda u 15 mladých mužů ve věku 20–32 let. Výsledek této studie přinesl, že obsah satelitních buněk je pozitivně ovlivněn zátěžovým cvičením.Po 30 dnech tréninku došlo ke zvýšení o 19 % a za 90 dní o 31 %.[5]
Reference
- BIRBRAIR, Alexander; DELBONO, Osvaldo. Pericytes are Essential for Skeletal Muscle Formation. Stem Cell Reviews and Reports. 2015-08, roč. 11, čís. 4, s. 547–548. Dostupné online [cit. 2021-03-16]. ISSN 1550-8943. DOI 10.1007/s12015-015-9588-6. (anglicky)
- KADI, Fawzi; SCHJERLING, Peter; ANDERSEN, Lars L. The effects of heavy resistance training and detraining on satellite cells in human skeletal muscles: Satellite cells, training and detraining. The Journal of Physiology. 2004-08, roč. 558, čís. 3, s. 1005–1012. Dostupné online [cit. 2021-03-16]. DOI 10.1113/jphysiol.2004.065904. PMID 15218062. (anglicky)
- SIEGEL, Ashley L.; KUHLMANN, Paige K.; CORNELISON, DDW. Muscle satellite cell proliferation and association: new insights from myofiber time-lapse imaging. Skeletal Muscle. 2011-02-02, roč. 1, čís. 1, s. 7. Dostupné online [cit. 2021-03-16]. ISSN 2044-5040. DOI 10.1186/2044-5040-1-7. PMID 21798086.
- ZAMMIT, Peter S.; PARTRIDGE, Terence A.; YABLONKA-REUVENI, Zipora. The Skeletal Muscle Satellite Cell: The Stem Cell That Came in From the Cold. Journal of Histochemistry & Cytochemistry. 2006-11, roč. 54, čís. 11, s. 1177–1191. Dostupné online [cit. 2021-03-16]. ISSN 0022-1554. DOI 10.1369/jhc.6R6995.2006. (anglicky)
- KADI, Fawzi; CHARIFI, Nadia; DENIS, Christian. The behaviour of satellite cells in response to exercise: what have we learned from human studies?. Pflügers Archiv - European Journal of Physiology. 2005-11, roč. 451, čís. 2, s. 319–327. Dostupné online [cit. 2021-03-16]. ISSN 0031-6768. DOI 10.1007/s00424-005-1406-6. (anglicky)
- RELAIX, Frédéric; ROCANCOURT, Didier; MANSOURI, Ahmed. A Pax3/Pax7-dependent population of skeletal muscle progenitor cells. Nature. 2005-06, roč. 435, čís. 7044, s. 948–953. Dostupné online [cit. 2021-03-16]. ISSN 0028-0836. DOI 10.1038/nature03594. (anglicky)
- BEAUCHAMP, Jonathan R.; HESLOP, Louise; YU, David S.W. Expression of Cd34 and Myf5 Defines the Majority of Quiescent Adult Skeletal Muscle Satellite Cells. Journal of Cell Biology. 2000-12-11, roč. 151, čís. 6, s. 1221–1234. Dostupné online [cit. 2021-03-17]. ISSN 0021-9525. DOI 10.1083/jcb.151.6.1221.
- MARCHILDON, François; LALA, Neena; LI, Grace. CCAAT/Enhancer Binding Protein Beta is Expressed in Satellite Cells and Controls Myogenesis. STEM CELLS. 2012-12, roč. 30, čís. 12, s. 2619–2630. Dostupné online [cit. 2021-03-17]. DOI 10.1002/stem.1248. (anglicky)
- MAURO, Alexander. SATELLITE CELL OF SKELETAL MUSCLE FIBERS. The Journal of Biophysical and Biochemical Cytology. 1961-02-01, roč. 9, čís. 2, s. 493–495. Dostupné online [cit. 2021-03-17]. ISSN 1540-8140. DOI 10.1083/jcb.9.2.493. (anglicky)
- MOURKIOTI, F; ROSENTHAL, N. IGF-1, inflammation and stem cells: interactions during muscle regeneration. Trends in Immunology. 2005-10, roč. 26, čís. 10, s. 535–542. Dostupné online [cit. 2021-03-18]. DOI 10.1016/j.it.2005.08.002. (anglicky)
- PARKER, Maura H.; SEALE, Patrick; RUDNICKI, Michael A. Looking back to the embryo: defining transcriptional networks in adult myogenesis. Nature Reviews Genetics. 2003-07, roč. 4, čís. 7, s. 497–507. Dostupné online [cit. 2021-03-18]. ISSN 1471-0056. DOI 10.1038/nrg1109. (anglicky)
- HAWKE, Thomas J.; GARRY, Daniel J. Myogenic satellite cells: physiology to molecular biology. Journal of Applied Physiology. 2001-08-01, roč. 91, čís. 2, s. 534–551. Dostupné online [cit. 2021-03-18]. ISSN 8750-7587. DOI 10.1152/jappl.2001.91.2.534. (anglicky)
- ANDERSON, Judy E; WOZNIAK, Ashley C. Satellite cell activation on fibers: modeling events in vivo — an invited review. Canadian Journal of Physiology and Pharmacology. 2004-05-01, roč. 82, čís. 5, s. 300–310. Dostupné online [cit. 2021-03-21]. ISSN 0008-4212. DOI 10.1139/y04-020. (anglicky)
- YANG, Shi Yu; GOLDSPINK, Geoffrey. Different roles of the IGF-I Ec peptide (MGF) and mature IGF-I in myoblast proliferation and differentiation. FEBS Letters. 2002-07-03, roč. 522, čís. 1–3, s. 156–160. Dostupné online [cit. 2021-03-22]. DOI 10.1016/S0014-5793(02)02918-6. (anglicky)
- BAMMAN, Marcas M.; SHIPP, James R.; JIANG, Jie. Mechanical load increases muscle IGF-I and androgen receptor mRNA concentrations in humans. American Journal of Physiology-Endocrinology and Metabolism. 2001-03-01, roč. 280, čís. 3, s. E383–E390. Dostupné online [cit. 2021-03-22]. ISSN 0193-1849. DOI 10.1152/ajpendo.2001.280.3.E383. (anglicky)