Superrozlišovací mikroskopie
Superrozlišovací mikroskopie je optická mikroskopie umožňující pozorovat objekty s rozlišením vyšším než difrakční limit. Ten při běžné světelné mikroskopii neumožňuje odlišit dva body bližší než přibližně 250 nm[1][2][3][4] Za pokroky ve vývoji těchto metod v roce 2014 získali Eric Betzig, Stefan W. Hell a William E. Moerner Nobelovu cena za chemii.[5]
4Pi mikroskopie
4Pi mikroskop je podobný klasickému konfokálnímu mikroskopu, ale má 2 stejné objektivy, každý na opačné straně vzorku, zaostřené na stejné místo. Obrazy z nich se skládají a ve výsledku tak fungují jako jeden objektiv s dvojnásobku numerickou aperturou, což vede ke zlepšení rozlišení. Díky interferenci proti sobě jdoucích paprsků se ještě více zmenšuje objem, do nějž se promítá bod, zejména v axiálním směru.[6][7] Výsledné laterální rozlišení dosahuje až 100 nm a axilální rozlišení až 190 nm.
Mikroskopie se strukturovaným osvětlením (SIM)
SIM (Structured Illumination Microscopy) využívá osvětlení vzorku světlem s pruhovaným vzorem vzniklým difrakcí na mřížce. Interferencí s detaily vzorku vzniká moiré efekt. Jeho následným počítačovým zpracováním lze spočítat, jak vypadaly struktury, jež ho způsobily, a získat tak obrázek obsahující jemnější detaily s rozlišením okolo 100 nm.[8][9]
Skenovací optická mikroskopie blízkého pole (NSOM)
NSOM (Near-field Scanning Optical Microscopy) zobrazuje vzorky pomocí skenování sondou nanometrových rozměrů, která slouží jako zdroj světla a/nebo detektor fluorescenčního záření. Jako sonda slouží hrot z průhledného materiálu v neprůhledném obalu, který má na konci miniaturní otvor. Otvor je podstatně menší než vlnová délka světla, které tak nemůže projít skrz, v jeho blízkém okolí se však tvoří evanescentní vlna, která dokáže fluorofory excitovat. Její intenzita exponenciálně klesá se vzdáleností, takže oblast, v níž se excitují fluorofory, je menší než difrakční limit, zhruba 100 nm.[10] Nevýhodou této metody je, že z principu dokáže zobrazovat jen povrch vzorku, zároveň ovšem nutně musí sbírat potenciálně zajímavé informace o topologii povrchu.
Vyčerpání stimulovanou emisí (STED)
STED (STimulated Emission Depletion) využívá možnosti vyčerpat energii z fluoroforu stimulovanou emisí. Zároveň s excitačním světlem se fluorofor osvětlí světlem s delší vlnovou délkou, které způsobí, že místo fluorescenčního záření se vyzáří světlo o vlnové délce excitačního záření, které je odfiltrováno. Paprsek laseru s vyšší vlnovou délkou má na průřezu tvar mezikruží, takže ke zhášení fluorescence dochází pouze u okraje oblasti osvícené excitačním laserem. Fluorescenční záření tak vzniká pouze v nezhášené oblasti uvnitř mezikruží, čímž dochází ke zlepšení rozlišení. Rozlišení závisí na tom, jak moc dokážeme omezit oblast, v níž nedochází k vyčerpávání fluorescence.[11] Ta je limitována intenzitou záření laseru s delší vlnovou délkou a u biologických vzorků limituje nejlepší dosažitelné rozlišení, protože při přílišné intenzitě osvětlení dochází k poškozování vzorku. V praxi se maximální rozlišení pohybuje okolo 60 nm.
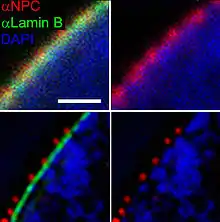
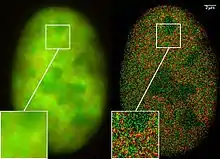
STORM, PALM a FPALM
Metody STORM (STochastic Optical Reconstruction Microscopy) [12], PALM (PhotoActivation Localization Microscopy) [13] a FPALM (Fluorescence PhotoActivation Localization Microscopy) [14] byly nezávisle publikovány krátce po sobě a využívají stejný princip. Fluorofory pro tyto techniky mají dva stavy, jeden schopný fluorescence a druhý fluorescence neschopný, které se dají přepínat světlem různých vlnových délek nebo se přepínají stochasticky. Ve stavu schopném fluorescence se nachází vždy jen velmi malý podíl všech fluoroforů, jejichž fluorescence se snímá, dokud nedojde k jejich vybělení. Poté se převede do stavu schopného fluorescence další malá část fluoroforů a snímají se, dokud se nevybělí. Tento postup se opakuje, dokud není nasnímáno dostatečné množství fluoroforů. Fotony nasnímané z jednoho fluoroforu jsou detekovány na širším prostoru podle rozptylové funkce (PSF, point spread function). Poté se matematicky určí střed PSF a danému fluoroforu se přiřadí tato spočítaná souřadnice. Čím více fotonů se detekuje z daného fluoroforu, tím lépe je definovaná PSF a tím přesnější je lokalizace fluoroforu. Lze dosáhnout rozlišení až v jednotkách nm. Jako fluorofory se využívají buď fotoaktivovatelné fluorescenční proteiny (např. PA-GFP) [13][14], nebo organické fluorescenční barvy (např. Cy5 spojená s Cy3) [12]. K aktivaci fluoroforu obvykle dochází osvícením laserem s nízkou intenzitou, využívající jinou barvu, než se poté využívá k vybuzení fluorescence. Nevýhodou těchto metod je obvykle delší doba snímání celkového obrazu, protože se musí nasnímat velké množství dílčích obrazů.
- Superrozlišovací mikroskopie





Reference
- Manuel Gunkel, Fabian Erdel, Karsten Rippe, Paul Lemmer, Rainer Kaufmann, Christoph Hörmann, Roman Amberger and Christoph Cremer: Dual color localization microscopy of cellular nanostructures. In: Biotechnology Journal, 2009, 4, 927-938. ISSN 1860-6768
- REYMANN, J; BADDELEY, D; GUNKEL, M; LEMMER, P; STADTER, W; JEGOU, T; RIPPE, K. High-precision structural analysis of subnuclear complexes in fixed and live cells via spatially modulated illumination (SMI) microscopy. Chromosome research : an international journal on the molecular, supramolecular and evolutionary aspects of chromosome biology. May 2008, s. 367–82. DOI 10.1007/s10577-008-1238-2. PMID 18461478. (anglicky)
- C. Cremer, R.Kaufmann, M. Gunkel, F. Polanski, P. Müller, R. Dierkes, S. Degenhard, C. Wege, M. Hausmann, U. Birk:"Application perspectives of localization microscopy in virology", Histochem Cell Biol (2014)
- Qiaoyun Wang, Rüdiger Dierkes, Rainer Kaufmanna, Christoph Cremer:"Quantitative analysis of individual hepatocyte growth factor receptor clusters in influenza A virus infected human epithelial cells using localization microscopy" Biochimica et Biophysica Acta (2014)
- Microscope work wins Nobel Prize. www.bbc.com. BBC, 8 October 2014. Dostupné online. (anglicky)
- CREMER, C.; CREMER, T. Considerations on a laser-scanning-microscope with high resolution and depth of field. Microscopia Acta. 1978, čís. 1, s. 31–44. Dostupné v archivu pořízeném dne 2016-03-04. Archivováno 4. 3. 2016 na Wayback Machine
- HELL, S.W., et al. Confocal microscopy with an increased detection aperture: type-B 4Pi confocal microscopy. Optics Letters. 1994, čís. 3, s. 222–224. Dostupné online. DOI 10.1364/OL.19.000222.
- GUSTAFSSON, M.G. Surpassing the lateral resolution limit by a factor of two using structured illumination microscopy. Journal of Microscopy. 2000, čís. 2, s. 82–87. DOI 10.1046/j.1365-2818.2000.00710.x.
- GUSTAFSSON, M.G. Nonlinear structured-illumination microscopy: Wide-field fluorescence imaging with theoretically unlimited resolution. PNAS. 2005, čís. 37, s. 13081–6. DOI 10.1073/pnas.0406877102.
- Cummings JR, Fellers TJ, Davidson MW. Specialized Microscopy Techniques - Near-Field Scanning Optical Microscopy [online]. 2007 [cit. 2007-08-22]. Dostupné v archivu pořízeném dne 2007-03-14. (anglicky)
- HUANG, Bo; BATES, M.; ZHUANG, X. Super resolution fluorescence microscopy. Annual Review of Biochemistry. 2009, s. 993–1016. DOI 10.1146/annurev.biochem.77.061906.092014.
- RUST, M.; BATES, M.; ZHUANG, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nature Methods. 2006, čís. 10, s. 793–796. DOI 10.1038/nmeth929.
- BETZIG, E., et al. Imaging Intracellular Fluorescent Proteins at Nanometer Resolution. Science. 2006, čís. 5793, s. 1642–1645. DOI 10.1126/science.1127344.
- HESS, S.; GIRIRIJAN, T.; MASON, M. Ultra-High Resolution Imaging by Fluorescence Photoactivation Localization Microscopy. Biophysical Journal. 2006, čís. 11, s. 4258–4272. DOI doi=10.1529/biophysj.106.091116.