Kyselina thioglykolová
Kyselina thioglykolová (TGA) (někdy též nazývaná kyselina merkaptooctová) je organická sloučenina, která obsahuje thiolovou i karboxylovou funkční skupinu. Jedná se o bezbarvou kapalinu s nepříjemným zápachem, která je mísitelná s polárními organickými rozpouštědly.[2][3]
| Kyselina thioglykolová | |
|---|---|
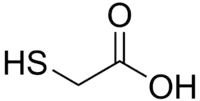
Strukturní vzorec | |
Model molekuly | |
| Obecné | |
| Systematický název | Kyselina sulfanylethanová |
| Ostatní názvy | Kyselina sulfanyloctová, acetylthiol, acetylmerkaptan |
| Anglický název | Thioglycolic acid |
| Sumární vzorec | C2H4O2S |
| Vzhled | bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 68-11-1 |
| PubChem | 1133 |
| ChEBI | 30065 |
| SMILES | C(C(=O)O)S |
| InChI | 1S/C2H4O2S/c3-2(4)1-5/h5H,1H2,(H,3,4) |
| Vlastnosti | |
| Molární hmotnost | 92,11 g/mol |
| Teplota tání | −16 °C (257 K) |
| Teplota varu | 96 °C (369 K) (5 mmHg) |
| Hustota | 1,32 g/cm3 |
| Disociační konstanta pKa | 3,83 (ionizace do prvního stupně) 9,3 (ionizace z prvního do druhého stupně) |
| Rozpustnost ve vodě | mísitelná |
| Tlak páry | 1,3 kPa (17,8 °C) |
| Měrná magnetická susceptibilita | −5,43×105 μm3/g |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| Teplota vzplanutí | >110 °C (>383 K) |
| Meze výbušnosti | 5,9 %-? |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Výroba
TGA se vyrábí reakcí draselné nebo sodné soli kyseliny chloroctové s hydrogensulfidem alkalického kovu ve vodném prostředí.[4] Lze ji taktéž získat z Bunteovy soli získané reakcí thiosíranu sodného s kyselinou chloroctovou.[3][5]
- ClCH2CO2H + Na2S2O3 → Na[O3S2CH2CO2H] + NaCl
- Na[O3S2CH2CO2H] + H2O → HSCH2CO2H + NaHSO4
Použití
Kyselina thioglykolová se, především ve formě vápenaté či sodné soli, používá jako depilační prostředek. Také se z níé vyrábějí thioglykoláty, využívané například v bakteriologii na přípravu thioglykolátových živných půd.[3] Struktura kondenzovaných taninů se studuje pomocí jejich thioglykolýzy (rozkladu kyselinou thioglykolovou).
Organocínové deriváty isooktylesterů kyseliny thioglykolové slouží jako stabilizátory PVC. Obecný vzorec těchto látek je R2Sn(SCH2CO2C8H17)2.[3]
Použití TGA může změkčit nehty.
Thioglykolát sodný nebo amonný se používá jako čistič kol, kde odstraňuje pozůstatky oxidů železa z ráfků.[6] Železnaté kationty v kombinaci s kyselinou thioglykolovou vytvářejí červenofialový[7] thioglykolát železitý.[8][9]
Reakce
Kyselina thioglykolová je s pKa (ionizace do prvního stupně) 3,83 výrazně silnější než kyselina octová:[3]
- HSCH2CO2H → HSCH2CO2− + H+
Hydrogenthioglykolátový anion má pKa 9,3:
- HSCH2CO2− → −SCH2CO2− + H+
Kyselina thioglykolová funguje, zejména při vyšších hodnotách pH, jako redukční činidlo. Oxiduje se na odpovídající disulfid (kyselinu dithiodiglykolovou):
- 2 HSCH2CO2H + "O" → [SCH2CO2H]2 + H2O
Reakce s ionty kovů
TGA, často jako dianion, tvoří komplexy s ionty kovů. Některé z těchto komplexu lze použít na zjištění přítomnosti železa, molybdenu, stříbra a cínu. TGA reaguje s diethylacetylmalonátem za vzniku kyseliny acetylmerkaptooctové a diethylmalonátu, redukčního činidla pro převod Fe3+ na Fe2+.[10]
Odkazy
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu kyselina thioglykolová na Wikimedia Commons
Obrázky, zvuky či videa k tématu kyselina thioglykolová na Wikimedia Commons
Reference
V tomto článku byl použit překlad textu z článku Thioglycolic acid na anglické Wikipedii.
- Thioglycolic acid. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- The Merck index, 14th ed.; O’Neil, Maryadele J., Ed.; Merck & Co., Inc.: Whitehouse Station, NJ, 2006; p 9342.
- Robert Rippel "Mercaptoacetic Acid and Derivatives" in Ullmann's Encyclopedia of Industrial Chemistry, 2012, Wiley-VCH, Weinheim.
- Cosmetic, Toiletry, and Fragrance Association (CTFA). Thioglycolic Acid. 1987;(1987a). Submission of unpublished data by CTFA Code No. 3-25-2
- Saeed M. Hameed N. Madan V. Mansoor S. Preparation and Mechanisms studies of Thioglycolic Acid. Pak. J. Sci. Ind. Res. 1992, 35: 131-132
- "SONAX Xtreme Wheel Cleaner" Safety data sheet
- JR, John J. McKetta. Encyclopedia of Chemical Processing and Design: Volume 12 - Corrosion to Cottonseed. [s.l.]: CRC Press, 1981-01-01. Dostupné online. ISBN 9780824724627. S. 103. (anglicky)
- LYONS, Edward. THIOGLYCOLIC ACID AS A COLOR TEST FOR IRON. Journal of the American Chemical Society. 1927-08-01, s. 1916–1920. Dostupné online. ISSN 0002-7863. DOI 10.1021/ja01407a010. (anglicky)
- Limit Test of Iron - Web Formulas [online]. [cit. 2016-06-14]. Dostupné online. (anglicky)
- Lee CW, Phil M. The detection of iron traces on hands by ferrozine sparys: a report on the sensitivity and interference of the method and recommended procedure in forensic science investigation. J Forensic Sci. 1986, 31:920-930.

