Kyselina chloristá
Kyselina chloristá HClO4 je jednou z nejsilnějších kyselin. Vyrábí se obvykle elektrochemickou oxidací chlorečnanů a komerčně se distribuuje jako vodný roztok o koncentraci přibližně 70 %, který je prakticky neomezeně stálý.
| Kyselina chloristá | |
|---|---|
 | |
 | |
| Obecné | |
| Systematický název | Kyselina chloristá |
| Anglický název | Perchloric acid |
| Německý název | Perchlorsäure |
| Sumární vzorec | HClO4 |
| Vzhled | Bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 7601-90-3 |
| SMILES | OCl(=O)(=O)=O |
| Číslo RTECS | SC7500000 |
| Vlastnosti | |
| Molární hmotnost | 100,459 g/mol |
| Teplota tání | −101,6 °C |
| Teplota varu | 39 °C (7,47 kPa) |
| Hustota | 1,768 g/cm3 (20 °C) 1,764 g/cm3 (22 °C) |
| Disociační konstanta pKa | −10 |
| Rozpustnost ve vodě | Neomezitelně mísitelná |
| Struktura | |
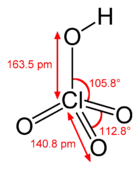
| Koordinační geometrie | čtyřstěnná |
| Tvar molekuly | čtyřstěn |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −40,6 kJ/mol (pevná látka) −129,4 kJ/mol (roztok) |
| Entalpie tání ΔHt | 69 J/g |
| Entalpie varu ΔHv | 398 J/g |
| Entalpie rozpouštění ΔHrozp | −885 J/g |
| Standardní molární entropie S° | 188 JK−1mol−1 (pevná látka) 182 JK−1mol−1 (roztok) |
| Standardní slučovací Gibbsova energie ΔGf° | 84,3 kJ/mol (pevná látka) −8,62 kJ/mol (roztok) |
| Izobarické měrné teplo cp | 1,199 JK−1mol−1 |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| R-věty | R5, R8, R35 |
| S-věty | S1/2, S23, S26, S36, S45 |
| NFPA 704 |  0
3
3
OX
|
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Ve zředěných roztocích se kyselina chloristá chová pouze jako velmi silná kyselina. V koncentrovaném stavu a za horka je ovšem mimořádně silným oxidačním prostředkem, využívaným např. k rozkladům stálých organických polymerů (polystyren, PVC). Doporučuje se však, aby uvedené reakce prováděl pouze zkušený chemik, protože při nich hrozí nebezpečí exploze. Zároveň je známo, že organické látky (např. dřevěné součásti laboratorních digestoří) mohou po dlouhodobém styku s parami kyseliny chloristé nebo oxidu chloristého samovolně explodovat.
Velká většina solí kyseliny chloristé – chloristanů – jsou sloučeniny velmi dobře rozpustné ve vodě. Výjimku tvoří chloristan draselný KClO4, chloristan rubidný RbClO4, chloristan cesný CsClO4 a chloristan amonný (NH4)ClO4. V analytické chemii slouží tento jev k důkazu nebo separaci uvedených kationtů.
Soli
- Chloristan draselný a amonný jsou složkou různých pyrotechnických směsí. Chloristan amonný je základem pevného paliva raketových motorů, využíval jej např. i americký raketoplán Space Shuttle.
Reference
- Perchloric acid. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
Literatura
- VOHLÍDAL, JIŘÍ; ŠTULÍK, KAREL; JULÁK, ALOIS. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
Externí odkazy
 Obrázky, zvuky či videa k tématu kyselina chloristá na Wikimedia Commons
Obrázky, zvuky či videa k tématu kyselina chloristá na Wikimedia Commons

