Indolamin 2,3-dioxygenáza
Indolamin 2,3-dioxygenáza (IDO nebo INDO EC 1.13.11.52) je enzym obsahující hemovou skupinu, který za fyziologických podmínek exprimuje řada tkání, mezi které patří například tenké střevo, plíce, ženský pohlavní trakt či placenta.[1] U lidí je kódován genem IDO1.[2][3] Tento enzym se účastní metabolismu tryptofanu, přičemž katalyzuje první limitující krok přeměny tryptofanu na formylkynurenin.[4] K enzymům zahajujícím takzvanou kynureninovou dráhu metabolismu tryptofanu patří také indolamin 2,3–dioxygenáza–like protein (IDO2)[5][6] a tryptofan 2,3-dioxygenáza (TDO).[7] IDO je důležitou součástí přirozené obrany těla proti patogenům.[8][9] Má imunosupresivní funkci a jeho působení může vést k anergii efektorových T lymfocytů[10], aktivaci T regulačních buněk[11] a může stimulovat dendritické buňky k diferenciaci na imunosupresivní fenotyp.[12] Exprese IDO byla prokázána také u různých typů nádorových linií, jako jsou akutní myeloidní leukémie, rakovina vaječníků či kolorektální karcinom.[10]
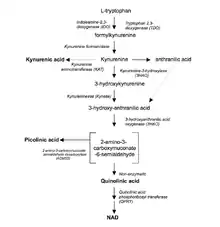
Fyziologická funkce
Enzym IDO hraje důležitou roli v imunitním systému a zároveň je jedním z mechanismů maligní transformace přispívajícím ke vzniku nádorového bujení. Exprese IDO je indukovaná IFNγ, což vysvětluje, proč je jeho aktivita zvýšená při zánětlivých onemocněních, jak infekčních, tak autoimunitních, stejně jako při tumorigenezi.[13] Jelikož je tryptofan pro přežití patogenů nezbytný, působení IDO je dokáže spolehlivě zničit. Mezi mikroorganismy citlivé na nedostatek tryptofanu patří například bakterie rodu Streptococcus[14] nebo viry jako herpes simplex[15] nebo spalničky[16]. IDO je důležitá molekula v mechanismech tolerance a mezi jeho fyziologické funkce patří potlačení potenciálně nebezpečných zánětlivých procesů v těle.[17] Tento enzym může být produkován alternativně aktivovanými M2 makrofágy a jinými imunoregulačními buňkami.[18] Aktivita IDO inhibuje funkci a proliferaci cytotoxických T lymfocytů, stimuluje T regulační lymfocyty[19] a také aktivuje myeloidní supresorové buňky, velmi často přítomné v nádoru.[20]
Klinický význam
Dnes již s jistotou víme, že exprese IDO umožňuje nádorovým buňkám uniknout imunitnímu systému dvěma hlavními mechanismy. Prvním z nich je deplece tryptofanu z nádorového mikroprostředí[21], druhým je pak produkce katabolických produktů, takzvaných kynureninů, které působí cytotoxicky nejen na T lymfocyty, ale například i NK buňky.[22] Nadměrnou expresi lidského enzymu IDO (hIDO) pozorujeme u celé řady lidských nádorových linií a tato skutečnost je často spojována s horší prognózou pacientů.[23][24] Mezi nádory spojovanými se zvýšenou produkcí IDO patří například karcinom prostaty, vaječníků či pankreatu, nádory žaludku, hlavy, plic anebo akutní myeloidní leukémie.[25][26] V nádorových buňkách je exprese IDO za normálních podmínek řízena genem Bin1, který je nádorovou transformací poškozen. Dnes již existují klinické studie, které naznačují, že kombinací inhibitorů IDO s klasickou chemoterapií a radioterapií, by mohlo být dosaženo obnovení imunitní kontroly a zajištění terapeutické odezvy jinak rezistentních nádorů.[27]
Inhibitory
Norharman vykazuje neuroprotektivní vlastnosti prostřednictvím inhibice IDO a zabráněním vzniku neurotoxických metabolitů, jako je kyselina chinolinová, 3-hydroxy-kynurenin a syntáza oxidu dusnatého.[28] Kyselina rosmarinová inhibuje expresi IDO prostřednictvím inhibice cyklooxygenázy.[29] Inhibitory COX2 snižují aktivitu IDO, což vede ke snížení hladiny kynureninů a aktivity prozánětlivých cytokinů.[30] Racemická směs 1-methyltryptofanu je dobrým inhibitorem IDO[31], ale přímé porovnání stereoizomerů v myších experimentálních modelech ukázalo, že D forma 1-methyltryptofanu lépe brání supresi T lymfocytů a je tedy vhodnější k posílení protinádorové imunitní odpovědi.[32] 1-methyl-D-tryptofan označovaný také jako indoximod je běžně používanou látkou v klinických studiích různých typů lidských malignit.[33] Mezi další inhibitory aktivity IDO patří látky epacadostat (INCB024360)[34], navoximod (GDC-0919)[35] a BMS-986205[36], které byly nebo právě jsou testovány v první či druhé fázi klinických zkoušek. Některé se dostaly dokonce do třetí fáze klinických testů a v kombinaci s moderní imunoterapií či klasickou léčbou představují nový způsob kombinované protinádorové terapie.
Reference
- YAMAZAKI, F; KUROIWA, T; TAKIKAWA, O. Human indolylamine 2,3-dioxygenase. Its tissue distribution, and characterization of the placental enzyme. Biochemical Journal. 1985-09-15, roč. 230, čís. 3, s. 635–638. Dostupné online [cit. 2019-02-14]. ISSN 0264-6021. DOI 10.1042/bj2300635.
- DAI, Wei; GUPTA, Sohan L. Molecular cloning, sequencing and expression of human interferon-γ-inducible indoleamine 2,3-dioxygenase cDNA. Biochemical and Biophysical Research Communications. Roč. 168, čís. 1, s. 1–8. Dostupné online [cit. 2018-02-16]. DOI 10.1016/0006-291x(90)91666-g.
- NAJFELD, V.; MENNINGER, J.; MUHLEMAN, D. Localization of indoleamine 2,3-dioxygenase gene (INDO) to chromosome 8p12→p11 by fluorescent in situ hybridization. Cytogenetic and Genome Research. 1993, roč. 64, čís. 3–4, s. 231–232. Dostupné online [cit. 2018-02-16]. ISSN 1424-8581. DOI 10.1159/000133584. (english)
- YAMAMOTO, Shozo; HAYAISHI, Osamu. [53] Tryptophan 2,3-dioxygenase (tryptophan pyrrolase) (rabbit intestine). [s.l.]: Elsevier Dostupné online. ISBN 9780121818746. S. 434–438.
- PRENDERGAST, George C.; METZ, Richard; MULLER, Alexander J. IDO2 in Immunomodulation and Autoimmune Disease. Frontiers in Immunology. 2014, roč. 5. Dostupné online [cit. 2018-02-16]. ISSN 1664-3224. DOI 10.3389/fimmu.2014.00585. (English)
- BALL, Helen J.; SANCHEZ-PEREZ, Angeles; WEISER, Silvia. Characterization of an indoleamine 2,3-dioxygenase-like protein found in humans and mice. Gene. 2007-07, roč. 396, čís. 1, s. 203–213. Dostupné online [cit. 2019-02-14]. ISSN 0378-1119. DOI 10.1016/j.gene.2007.04.010.
- BADAWY, Abdulla A.-B.; BANO, Samina. Tryptophan Metabolism in Rat Liver after Administration of Tryptophan, Kynurenine Metabolites, and Kynureninase Inhibitors. International Journal of Tryptophan Research. 2016-01, roč. 9, s. IJTR.S38190. Dostupné online [cit. 2019-02-14]. ISSN 1178-6469. DOI 10.4137/ijtr.s38190.
- YOSHIDA, R.; HAYAISHI, O. Induction of pulmonary indoleamine 2,3-dioxygenase by intraperitoneal injection of bacterial lipopolysaccharide.. Proceedings of the National Academy of Sciences. 1978-08-01, roč. 75, čís. 8, s. 3998–4000. Dostupné online [cit. 2019-02-14]. ISSN 0027-8424. DOI 10.1073/pnas.75.8.3998.
- YOSHIDA, R.; URADE, Y.; TOKUDA, M. Induction of indoleamine 2,3-dioxygenase in mouse lung during virus infection.. Proceedings of the National Academy of Sciences. 1979-08-01, roč. 76, čís. 8, s. 4084–4086. Dostupné online [cit. 2019-02-14]. ISSN 0027-8424. DOI 10.1073/pnas.76.8.4084.
- UYTTENHOVE, Catherine; PILOTTE, Luc; THÉATE, Ivan. Evidence for a tumoral immune resistance mechanism based on tryptophan degradation by indoleamine 2,3-dioxygenase. Nature Medicine. 2003-09-21, roč. 9, čís. 10, s. 1269–1274. Dostupné online [cit. 2019-02-14]. ISSN 1078-8956. DOI 10.1038/nm934.
- SHARMA, Madhav D.; BABAN, Babak; CHANDLER, Phillip. Plasmacytoid dendritic cells from mouse tumor-draining lymph nodes directly activate mature Tregs via indoleamine 2,3-dioxygenase. Journal of Clinical Investigation. 2007-09-04, roč. 117, čís. 9, s. 2570–2582. Dostupné online [cit. 2019-02-14]. ISSN 0021-9738. DOI 10.1172/jci31911.
- QUINTANA, F. J.; MURUGAIYAN, G.; FAREZ, M. F. An endogenous aryl hydrocarbon receptor ligand acts on dendritic cells and T cells to suppress experimental autoimmune encephalomyelitis. Proceedings of the National Academy of Sciences. 2010-11-10, roč. 107, čís. 48, s. 20768–20773. Dostupné online [cit. 2019-02-14]. ISSN 0027-8424. DOI 10.1073/pnas.1009201107.
- MELLOR, Andrew L.; LEMOS, Henrique; HUANG, Lei. Indoleamine 2,3-Dioxygenase and Tolerance: Where Are We Now?. Frontiers in Immunology. 2017-10-27, roč. 8. PMID 29163470 PMCID: PMC5663846. Dostupné online [cit. 2018-02-16]. ISSN 1664-3224. DOI 10.3389/fimmu.2017.01360. PMID 29163470.
- MACKENZIE, Colin R.; HADDING, Ulrich; DÄUBENER, Walter. Interferon‐γ‐Induced Activation of Indoleamine 2,3‐Dioxygenase in Cord Blood Monocyte‐Derived Macrophages Inhibits the Growth of Group B Streptococci. The Journal of Infectious Diseases. 1998-09, roč. 178, čís. 3, s. 875–878. Dostupné online [cit. 2019-02-15]. ISSN 0022-1899. DOI 10.1086/515347.
- ADAMS, O.; BESKEN, K.; OBERDORFER, C. Role of Indoleamine-2,3-Dioxygenase in Alpha/Beta and Gamma Interferon-Mediated Antiviral Effects against Herpes Simplex Virus Infections. Journal of Virology. 2004-02-12, roč. 78, čís. 5, s. 2632–2636. Dostupné online [cit. 2019-02-15]. ISSN 0022-538X. DOI 10.1128/jvi.78.5.2632-2636.2004.
- OBOJES, K.; ANDRES, O.; KIM, K. S. Indoleamine 2,3-Dioxygenase Mediates Cell Type-Specific Anti-Measles Virus Activity of Gamma Interferon. Journal of Virology. 2005-05-26, roč. 79, čís. 12, s. 7768–7776. Dostupné online [cit. 2019-02-15]. ISSN 0022-538X. DOI 10.1128/jvi.79.12.7768-7776.2005.
- ROMANI, Luigina; FALLARINO, Francesca; DE LUCA, Antonella. Defective tryptophan catabolism underlies inflammation in mouse chronic granulomatous disease. Nature. 2008-01, roč. 451, čís. 7175, s. 211–215. Dostupné online [cit. 2019-02-15]. ISSN 0028-0836. DOI 10.1038/nature06471.
- MOON, Yong Wha; HAJJAR, Joud; HWU, Patrick. Targeting the indoleamine 2,3-dioxygenase pathway in cancer. Journal for Immunotherapy of Cancer. 2015-12-15, roč. 3. PMID 26674411 PMCID: PMC4678703. Dostupné online [cit. 2018-02-16]. ISSN 2051-1426. DOI 10.1186/s40425-015-0094-9. PMID 26674411.
- CURTI, A.; TRABANELLI, S.; SALVESTRINI, V. The role of indoleamine 2,3-dioxygenase in the induction of immune tolerance: focus on hematology. Blood. 2008-11-20, roč. 113, čís. 11, s. 2394–2401. Dostupné online [cit. 2019-02-15]. ISSN 0006-4971. DOI 10.1182/blood-2008-07-144485.
- HOLMGAARD, Rikke B.; ZAMARIN, Dmitriy; LI, Yanyun. Tumor-Expressed IDO Recruits and Activates MDSCs in a Treg-Dependent Manner. Cell Reports. 2015-10, roč. 13, čís. 2, s. 412–424. Dostupné online [cit. 2019-02-15]. ISSN 2211-1247. DOI 10.1016/j.celrep.2015.08.077.
- MUNN, David H.; SHAFIZADEH, Ebrahim; ATTWOOD, John T. Inhibition of T Cell Proliferation by Macrophage Tryptophan Catabolism. The Journal of Experimental Medicine. 1999-05-03, roč. 189, čís. 9, s. 1363–1372. Dostupné online [cit. 2019-02-15]. ISSN 0022-1007. DOI 10.1084/jem.189.9.1363.
- FRUMENTO, Guido; ROTONDO, Rita; TONETTI, Michela. Tryptophan-derived Catabolites Are Responsible for Inhibition of T and Natural Killer Cell Proliferation Induced by Indoleamine 2,3-Dioxygenase. The Journal of Experimental Medicine. 2002-08-12, roč. 196, čís. 4, s. 459–468. Dostupné online [cit. 2019-02-15]. ISSN 0022-1007. DOI 10.1084/jem.20020121.
- OKAMOTO, Aikou; NIKAIDO, Takashi; OCHIAI, Kazunori. Ido serves as a marker of poor prognosis in gene expression profiles of serous ovarian cancer cells. International Congress Series. 2007-11, roč. 1304, s. 262–273. Dostupné online [cit. 2019-02-15]. ISSN 0531-5131. DOI 10.1016/j.ics.2007.07.053.
- INABA, Tomoko; INO, Kazuhiko; KAJIYAMA, Hiroaki. Indoleamine 2,3-dioxygenase expression predicts impaired survival of invasive cervical cancer patients treated with radical hysterectomy. Gynecologic Oncology. 2010-06, roč. 117, čís. 3, s. 423–428. Dostupné online [cit. 2019-02-15]. ISSN 0090-8258. DOI 10.1016/j.ygyno.2010.02.028.
- UYTTENHOVE, Catherine; PILOTTE, Luc; THÉATE, Ivan. Evidence for a tumoral immune resistance mechanism based on tryptophan degradation by indoleamine 2,3-dioxygenase. Nature Medicine. 2003/10, roč. 9, čís. 10, s. 1269–1274. Dostupné online [cit. 2018-02-16]. ISSN 1546-170X. DOI 10.1038/nm934. (En)
- JIANG, Tianze; SUN, Yingying; YIN, Zhichao. Research progress of indoleamine 2,3-dioxygenase inhibitors. Future Medicinal Chemistry. 2015-02-16, roč. 7, čís. 2, s. 185–201. Dostupné online [cit. 2018-02-16]. DOI 10.4155/fmc.14.151. (EN)
- MULLER, Alexander J; DUHADAWAY, James B; DONOVER, P Scott. Inhibition of indoleamine 2,3-dioxygenase, an immunoregulatory target of the cancer suppression gene Bin1, potentiates cancer chemotherapy. Nature Medicine. 2005/03, roč. 11, čís. 3, s. 312–319. Dostupné online [cit. 2018-02-16]. ISSN 1546-170X. DOI 10.1038/nm1196. (En)
- CHIARUGI, A.; DELLO SBARBA, P.; PACCAGNINI, A. Combined inhibition of indoleamine 2,3-dioxygenase and nitric oxide synthase modulates neurotoxin release by interferon-gamma-activated macrophages. Journal of Leukocyte Biology. August 2000, roč. 68, čís. 2, s. 260–266. PMID 10947071. Dostupné online [cit. 2018-02-16]. ISSN 0741-5400. PMID 10947071.
- LEE, Hwa Jung; JEONG, Young-Il; LEE, Tae-Hyung. Rosmarinic acid inhibits indoleamine 2,3-dioxygenase expression in murine dendritic cells. Biochemical Pharmacology. Roč. 73, čís. 9, s. 1412–1421. Dostupné online [cit. 2018-02-16]. DOI 10.1016/j.bcp.2006.12.018.
- CESARIO, A.; ROCCA, B.; RUTELLA, S. The Interplay between Indoleamine 2,3-Dioxygenase 1 (IDO1) and Cyclooxygenase (COX)-2 In Chronic Inflammation and Cancer. Current Medicinal Chemistry. 2011-05-01, roč. 18, čís. 15, s. 2263–2271. Dostupné online [cit. 2018-02-16]. DOI 10.2174/092986711795656063. (anglicky)
- HOU, De-Yan; MULLER, Alexander J.; SHARMA, Madhav D. Inhibition of Indoleamine 2,3-Dioxygenase in Dendritic Cells by Stereoisomers of 1-Methyl-Tryptophan Correlates with Antitumor Responses. Cancer Research. 2007-01-15, roč. 67, čís. 2, s. 792–801. Dostupné online [cit. 2018-02-16]. DOI 10.1158/0008-5472.can-06-2925.
- HOU, D.-Y.; MULLER, A. J.; SHARMA, M. D. Inhibition of Indoleamine 2,3-Dioxygenase in Dendritic Cells by Stereoisomers of 1-Methyl-Tryptophan Correlates with Antitumor Responses. Cancer Research. 2007-01-15, roč. 67, čís. 2, s. 792–801. Dostupné online [cit. 2019-02-15]. ISSN 0008-5472. DOI 10.1158/0008-5472.can-06-2925.
- SOLIMAN, Hatem H.; JACKSON, Erica; NEUGER, Tony. A first in man phase I trial of the oral immunomodulator, indoximod, combined with docetaxel in patients with metastatic solid tumors. Oncotarget. 2014-08-22, roč. 5, čís. 18. Dostupné online [cit. 2019-02-15]. ISSN 1949-2553. DOI 10.18632/oncotarget.2357.
- BEATTY, Gregory L.; O'DWYER, Peter J.; CLARK, Jason. First-in-Human Phase I Study of the Oral Inhibitor of Indoleamine 2,3-Dioxygenase-1 Epacadostat (INCB024360) in Patients with Advanced Solid Malignancies. Clinical Cancer Research. 2017-01-04, roč. 23, čís. 13, s. 3269–3276. Dostupné online [cit. 2019-02-15]. ISSN 1078-0432. DOI 10.1158/1078-0432.ccr-16-2272.
- BURRIS, Howard A.; GORDON, Michael S.; HELLMANN, Matthew David. A phase Ib dose escalation study of combined inhibition of IDO1 (GDC-0919) and PD-L1 (atezolizumab) in patients (pts) with locally advanced or metastatic solid tumors.. Journal of Clinical Oncology. 2017-05-20, roč. 35, čís. 15_suppl, s. 105–105. Dostupné online [cit. 2019-02-15]. ISSN 0732-183X. DOI 10.1200/jco.2017.35.15_suppl.105.
- SIU, Lillian L.; GELMON, Karen; CHU, Quincy. Abstract CT116: BMS-986205, an optimized indoleamine 2,3-dioxygenase 1 (IDO1) inhibitor, is well tolerated with potent pharmacodynamic (PD) activity, alone and in combination with nivolumab (nivo) in advanced cancers in a phase 1/2a trial. Cancer Research. 2017-07-01, roč. 77, čís. 13 Supplement, s. CT116–CT116. Dostupné online [cit. 2019-02-15]. ISSN 0008-5472. DOI 10.1158/1538-7445.am2017-ct116.