Haberův–Boschův proces
Haberův–Boschův proces, nebo také Haberova-Boschova syntéza je umělý proces fixace dusíku, který je v současnosti hlavním postupem pro průmyslovou výrobu amoniaku. Proces přeměňuje atmosférický dusík (N2) na amoniak (NH3) reakcí s vodíkem (H2) za vysokého tlaku a teploty a za přítomnosti kovového katalyzátoru.

.jpg.webp)
Proces nese jméno svého objevitele, německého chemika Fritze Habera, který jej vyvinul na počátku 20. století. Carl Bosch, chemik firmy BASF, následně Haberův proces přepracoval do průmyslového měřítka.
Před vznikem Haberova procesu byla průmyslová výroba amoniaku obtížná.[1][2][3]. Používané postupy, jako například Birkelandův-Eydeův proces nebo Frankův-Carův proces byly značně neefektivní.
Haberův proces se dnes používá především při výrobě průmyslových hnojiv. Během 1. světové války však umožnil Německu získat amoniak potřebný na produkci výbušnin, náhradou původně užívaného chilského ledku, nedostupného kvůli spojenecké námořní blokádě.
Historie

V průběhu 19. století se postupně zvyšovala poptávka po dusičnanech a amoniaku, využívaných jako hnojiva a průmyslové suroviny. Jejich hlavním zdrojem byla tehdy těžba ledku. Počátkem 20. století bylo předpovídáno, že tyto nerostné zásoby nebudou dostačovat budoucí poptávce[4]. Výzkumné snahy pro získání možných nových zdrojů amoniaku získávaly na důležitosti. Zjevným zdrojem byl atmosférický dusík (N2), který tvoří téměř 80 % vzduchu. Vzdušný N2 je však velmi stabilní a nereaguje přímo s jinými chemikáliemi. Nalezení způsobu přeměny N2 na amoniak bylo výzvou pro chemiky na celém světě.
Německý chemik Fritz Haber vynalezl na počátku 20. století katalytický postup syntézy amoniaku. Se svým asistentem Robertem Le Rossignol vyvinul vysokotlaká zařízení a katalyzátory potřebné pro demonstraci Haberova procesu v laboratorním měřítku.[5][6] Haber se svým asistentem předvedli svůj proces výroby amoniaku ze vzduchu v létě roku 1909. Vyráběné množství bylo asi 125 ml za hodinu. Proces zakoupil německý chemický koncern BASF, který pověřil svého vědce Carla Bosche úkolem převést Haberovu laboratorní metodu na postup výroby v průmyslovém měřítku.[2] V roce 1910 Bosch svůj úkol úspěšně splnil. Haber a Bosch byli v letech 1918 resp. 1931 oceněni Nobelovou cenou za svou práci na překonání chemických a technických překážek při vývoji průmyslové vysokotlaké a kontinuální technologie výroby.[7]
Průmyslová výroba amoniaku za použití Haberova procesu začala roku 1913 v továrně BASF v německém Ludwigshafenu. Následující rok tamější denní produkce dosáhla 20 tun amoniaku.[8]
Během první světové války bylo pro výrobu výbušnin zapotřebí velkého množství dusičnanů. Spojenci měli přístup k velkým nalezištím dusičnanu sodného v Chile (tzv. chilský ledek), která kontrolovaly britské společnosti. Němci naproti tomu neměli žádné takové zdroje, takže Haberův proces se stal pro německé válečné úsilí klíčovým.[7][9] Syntetický amoniak vyrobený Haberovým procesem se používal pro výrobu kyseliny dusičné, suroviny pro dusičnany obsažené ve výbušninách.
Proces
Konverze normálně probíhá při tlaku 15–25 MPa a teplotě 400–500 °C. Plyny (dusík a vodík) procházejí čtyřmi vrstvami katalyzátoru, mezi každým průchodem jsou chlazeny kvůli udržení přijatelné rovnovážné konstanty (poměr reaktantů a produktu) a tím efektivity procesu. Během každého průchodu dochází ke jen asi 15% konverzi, nezreagované plyny jsou však recyklovány a výsledná konverze dosahuje asi 97 %.
Další kroky, jako parní reforming, konverze vodního plynu, odstranění CO2 a methanace probíhají za tlaku asi 2,5–3,5 MPa. Celý systém syntézy amoniaku pracuje za tlaků 6–18 MPa, v závislosti na konkrétním použitém patentovém postupu.
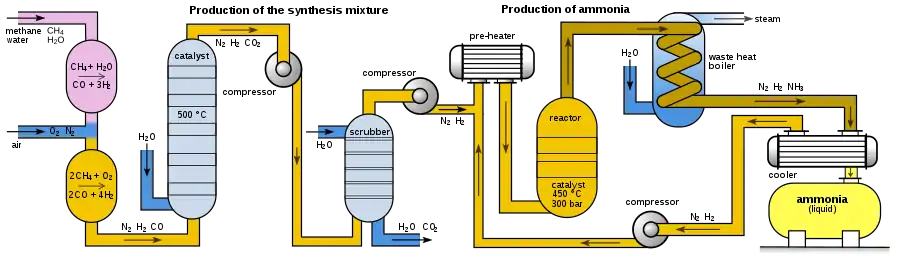
Zdroje vodíku
Nejužívanějším zdrojem vodíku je methan získaný ze zemního plynu. Konverze (tzv. parní reforming) je prováděna parou za vysoké teploty a tlaku za přítomnosti niklového katalyzátoru. Jejím výsledkem je rozdělení molekul uhlíku a vodíku.
Methan katalyticky reaguje s vodní párou za vzniku oxidu uhelnatého a vodíku:
- CH4 (g) + H2O (g) → CO (g) + 3 H2 (g)
Vytvořený oxid uhelnatý reaguje s vodou za vzniku oxidu uhličitého a vodíku:
- CO (g) + H2O (g) → CO2 (g) + H2 (g)
Celková reakce je tedy:
- CH4 (g) + 2 H2O (g) → CO2 (g) + 4 H2 (g)
Reakční rychlost a rovnováha
Dusík (N2) je velmi nereaktivní, protože atomy v molekule váže extrémně silná trojná vazba. Haberův proces používá katalyzátor, který urychluje rozštěpení této trojné vazby.
Při této syntéze je nutné zohlednit dvě protichůdná kritéria: složení rovnovážné směsi a reakční rychlost. Při pokojové teplotě chemická rovnováha směsi silně upřednostňuje amoniak, avšak reakce probíhá s prakticky nulovou rychlostí. Zjevným řešením je zvýšit teplotu, jelikož je ale reakce exotermická, rovnovážná konstanta dosahuje hodnoty 1 (stejné množství reaktantů a produktů) při teplotách okolo 150–200 °C (viz Le Chatelierův princip).
| Teplota (°C) | Kp |
|---|---|
| 300 | 4.34 × 10−3 |
| 400 | 1.64 × 10−4 |
| 450 | 4.51 × 10−5 |
| 500 | 1.45 × 10−5 |
| 550 | 5.38 × 10−6 |
| 600 | 2.25 × 10−6 |
Nad touto teplotou a za atmosférického tlaku se rovnováha rychle posouvá na stranu reaktantů, jak vyplývá z Van 't Hoffovy rovnice. Zdálo by se, že je vhodné pracovat za nižších teplot a použít jiný způsob k dosažení dostatečné reakční rychlosti. Avšak samotný katalyzátor pro svou efektivní funkci potřebuje teplotu alespoň 400 °C. Tato teplota, používaná při Haberově procesu, je tedy kompromisem mezi přijatelnou efektivitou a rychlostí reakce.
Protože v rovnici syntézy N2 + 3 H2 → 2 NH3 figurují čtyři moly reaktantů na dva moly produktu, je zvýšení tlaku další zjevnou volbou k posunutí reakční rovnováhy na stranu produktu. Z ekonomického hlediska je použití velmi vysokého tlaku nákladné (potřeba dostatečně dimenzovaných vysokotlakých aparátů, armatur, značná energetická náročnost vysokotlakých kompresorů, nutnost zvýšených bezpečnostních opatření atd.). Haberův–Boschův proces běžně využívá tlaky kolem 15–25 MPa, umožňující dosažení přijatelné 15% konverze při pracovních teplotách kolem 400–500 °C.[11]
Další cestou ke zvýšení výnosu reakce by bylo odvedení produktu (tj. plynného amoniaku) ze systému. V praxi však odchází v rovnovážné směsi plynů, opouštějících reaktor. Horké plyny jsou ochlazeny, avšak zůstávají na vysokém tlaku, což dovoluje kondenzaci amoniaku. Nezreagovaný dusík a vodík se vrací zpět do reaktoru na opětovnou syntézu.
Katalyzátory
Nejpoužívanější katalyzátory jsou na bázi železa, doplněné přídavkem K2O, CaO, SiO2, a Al2O3. Původní Haberovy–Boschovy reakční komory používaly jako katalyzátor osmium, které však bylo těžce dostupné. Haber poznamenal, že uran je téměř stejně efektivní a snadněji dostupný než osmium. Pod Boschovým vedením objevil roku 1909 výzkumník BASFu Alwin Mittasch mnohem méně nákladný katalyzátor založený na železe, který se používá dodnes. Některé postupy používají katalyzátory na bázi ruthenia (proces KAAP). Ruthenium tvoří aktivnější katalytické prostředí, které dovoluje nižší pracovní tlaky.
V průmyslové praxi se železný katalyzátor získává z jemně namletého práškového železa, které se obvykle vyrábí redukcí vysoce čistého magnetitu (Fe3O4). Práškové železo se spálí (oxiduje), aby se dosáhlo magnetitu o definované velikosti částic. Částice magnetitu se poté částečně redukují pro odstranění části kyslíku. Výsledné částice katalyzátoru mají jádro z magnetitu obklopené obalem z oxidu železnatého (FeO), který je dále obalen slupkou z kovového železa. Katalyzátor si během redukce udržuje většinu objemu. Výsledkem je vysoce porézní materiál s velkorozměrným aktivním povrchem, což zlepšuje jeho katalytické vlastnosti. Další doplňkové složky katalyzátoru tvoří oxidy vápníku a hliníku, které zpevňují železný katalyzátor a pomáhají mu udržet jeho povrch. Tyto oxidy Ca, Al, K, a Si jsou netečné k redukci vodíkem.
Reakční mechanismus, zahrnující heterogenní katalyzátor, zřejmě obsahuje následující kroky:[12]
- N2 (g) → N2 (adsorbovaný)
- N2 (adsorbovaný) → 2 N (adsorbovaný)
- H2 (g) → H2 (adsorbovaný)
- H2 (adsorbovaný) → 2 H (adsorbovaný)
- N (adsorbovaný) + 3 H (adsorbovaný)→ NH3 (adsorbovaný)
- NH3 (adsorbovaný) → NH3 (g)
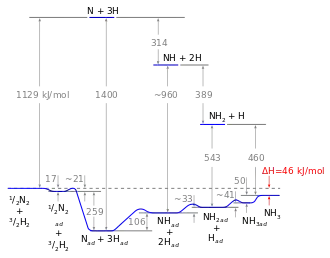
Reakce 5 probíhá ve třech krocích: tvorba NH, NH2, a poté NH3. Experimentální důkazy naznačují, že reakce 2 probíhá pomalu a určuje celkovou rychlost syntézy. Tato skutečnost není překvapivá vzhledem k tomu, že se při této reakci štěpí nejsilnější vazba - trojná vazba dusíkové molekuly.
Hlavní zásluhu na objasnění tohoto reakčního mechanismu nese německý fyzik Gerhard Ertl.[13]
Ekonomické a environmentální dopady

Při svém vzniku musel Haberův proces soupeřit s dalším průmyslovým postupem, kyanamidovým procesem. Ten však vyžadoval velké množství elektrické energie a byl náročnější na pracovní sílu.[7]:s.137–143
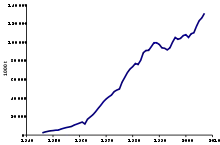
Haberův proces v současnosti ročně produkuje 450 milionů tun dusíkatých hnojiv, převážně ve formě bezvodého amoniaku, dusičnanu amonného a močoviny. Haberův proces spotřebuje 3 až 5 % světové produkce zemního plynu (asi 1–2 % světové roční spotřeby energie).[14][15][16][17] V kombinaci s pesticidy tato hnojiva zčtyřnásobila produktivitu zemědělské půdy:
"Při průměrném výnosu na úrovni roku 1900 by sklizeň plodin v roce 2000 vyžadovala téměř čtyřnásobnou plochu. Obdělávaná půda by musela zahrnovat téměř polovinu nezamrzající plochy všech kontinentů, oproti současným asi 15 %."[18]
Kvůli svému rozsáhlému dopadu na schopnost lidstva pěstovat potraviny účinkoval Haberův–Boschův proces jako „detonátor lidské populace“, která následně vzrostla z asi 1,6 miliardy v roce 1900 na současných 7 miliard.[19] Téměř 80 % dusíku v lidských tkáních má původ v Haberově–Boschově procesu.[20] Protože využitelnost dusíku je typicky méně než 50%,[21] má toto rozsáhlé používání průmyslové fixace dusíku neblahé následky na ekosystém.[1][20]
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Haber process na anglické Wikipedii.
- SMIL, Vaclav. Enriching the Earth: Fritz Haber, Carl Bosch, and the Transformation of World Food Production. 1st. vyd. Cambridge, MA: MIT, 2004. ISBN 9780262693134. (anglicky)
- HAGER, Thomas. The Alchemy of Air: A Jewish genius, a doomed tycoon, and the scientific discovery that fed the world but fueled the rise of Hitler. 1st. vyd. New York, NY: Harmony Books, 2008. ISBN 978-0-307-35178-4. (anglicky)
- SITTIG, Marshall. Fertilizer Industry: Processes, Pollution Control, and Energy Conservation. Park Ridge, NJ: Noyes Data Corp., 1979. ISBN 0-8155-0734-8. (anglicky)
- JAMES, Laylin K. Nobel Laureates in Chemistry 1901–1992. 3rd. vyd. Washington,DC: American Chemical Society, 1993. Dostupné online. ISBN 0-8412-2690-3. S. 118. (anglicky)
- HABER, Fritz. Thermodynamik technischer Gasreaktionen. 1st. vyd. Paderborn: Salzwasser Verlag, 2012. ISBN 9783864448423. (German)
- Robert Le Rossignol, 1884–1976: Professional Chemist. ChemUCL Newsletter. UCL Department of Chemistry, 2009, s. 8. Dostupné v archivu pořízeném dne 13-01-2011. (anglicky)
- HAGER, T. The Alchemy of Air. New York, NY: Harmony Books, 2008. (anglicky)
- Philip & Phyllis Morris, "From Fertile Minds" (review) American Scientist, 2001
- Nobel Award to Haber. New York Times. 3 February 1920. Dostupné online [cit. 11 October 2010]. (anglicky)
- BROWN, Theodore L.; LEMAY, H. Eugene, Jr; BURSTEN, Bruce E. Chemistry: The Central Science. 10th. vyd. Upper Saddle River, NJ: Pearson, 2006. ISBN 0-13-109686-9. Kapitola Table 15.2. (anglicky)
- The Haber process [online]. www.chemguide.co.uk [cit. 2017-01-28]. Dostupné online.
- WENNERSTRÖM, Håkan; LIDIN, Sven. Scientific Background on the Nobel Prize in Chemistry 2007 Chemical Processes on Solid Surfaces [online]. Swedish Academy of Sciences [cit. 2015-09-17]. Dostupné online. (anglicky)
- BOZSO, F.; ERTL, G.; GRUNZE, M.; WEISS, M. Interaction of nitrogen with iron surfaces: I. Fe(100) and Fe(111). J. Catal.. 1977, s. 18–41. DOI 10.1016/0021-9517(77)90237-8. (anglicky). IMBIHL, R.; BEHM, R. J.; ERTL, G.; MORITZ, W. The structure of atomic nitrogen adsorbed on Fe(100). Surf. Sci.. 1982, s. 129–140. DOI 10.1016/0039-6028(82)90135-2. Bibcode 1982SurSc.123..129I. (anglicky). ERTL, G.; LEE, S. B.; WEISS, M. Kinetics of nitrogen adsorption on Fe(111). Surf. Sci.. 1982, s. 515–526. DOI 10.1016/0039-6028(82)90702-6. Bibcode 1982SurSc.114..515E. (anglicky). ERTL, G. Primary steps in catalytic synthesis of ammonia. J. Vac. Sci. Tech. A. 1983, s. 1247–1253. DOI 10.1116/1.572299. (anglicky)
- SMIL, Vaclav. Enriching the Earth: Fritz Haber, Carl Bosch, and the Transformation of World Food Production. Cambridge, MA: MIT Press, 2004. ISBN 9780262693134. (anglicky)
- International Energy Outlook 2007 [online]. Dostupné online. (anglicky)
- Fertilizer statistics. ? [online]. [cit. 2017-01-29]. Dostupné v archivu pořízeném dne 24-04-2008. (anglicky)
- SMITH, Barry E. Structure. Nitrogenase reveals its inner secrets. Science. September 2002, s. 1654–5. DOI 10.1126/science.1076659. PMID 12215632. (anglicky)
- SMIL, Vaclav. Nitrogen cycle and world food production. World Agriculture. 2011, s. 9–1. Dostupné online. (anglicky)
- SMIL, Vaclav. Detonator of the population explosion. Nature. 1999, s. 415. Dostupné online. DOI 10.1038/22672. (anglicky)
- HOWARTH, R. W. Coastal nitrogen pollution: a review of sources and trends globally and regionally. Harmful Algae. 2008, s. 14–20. DOI 10.1016/j.hal.2008.08.015. (anglicky)
- OENEMA, O.; WITZKE, H.P.; KLIMONT, Z.; LESSCHEN, J.P.; VELTHOF, G.L. Integrated assessment of promising measures to decrease nitrogen losses in agriculture in EU-27. Agriculture, Ecosystems and Environment. 2009, s. 280–288. DOI 10.1016/j.agee.2009.04.025. (anglicky)
Externí odkazy
 Obrázky, zvuky či videa k tématu Haberův–Boschův proces na Wikimedia Commons
Obrázky, zvuky či videa k tématu Haberův–Boschův proces na Wikimedia Commons - Haber-Bosch process, Nature, July 29, 1999, p 415 (anglicky)
- BASF - Fertilizer out of thin air (anglicky)
- Uses and Production of Ammonia (anglicky)
- Haber Process for Ammonia Synthesis (anglicky)
- The Haber Process [online]. Dostupné online. (anglicky)