Glykogenfosforyláza
Glykogenfosforyláza (někdy prostě „fosforyláza“[1]) je enzym ze skupiny transferáz, který katalyzuje první krok rozkladu glykogenu. Název je odvozen od skutečnosti, že přenáší anorganickou fosfátovou skupinu na glukózové podjednotky glykogenu za vzniku glukóza-1-fosfátů. Tento enzym vyžaduje celou řadu pomocných kofaktorů a je dále pečlivě regulován, čímž se stává ústředním bodem metabolismu glykogenu (a vůbec sacharidů) v živočišné buňce.
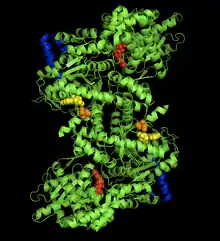
Struktura
Glykogenfosforyláza je ve skutečnosti dimer dvou identických podjednotek (tedy homodimer), každá o velikosti 97 kDa (Mr 97 000), 842 aminokyselin.[1] Přesná struktura se liší v rámci jednotlivých tkání a u člověka jsou tedy známy tři izoformy, v játrech, svalech a mozku.[2] Bez ohledu na izoformu však glykogenfosforyláza prochází zásadními strukturními změnami po fosforylaci svého serinu na pozici 14. Enzym s fosfátem na této pozici se označuje jako fosforyláza a a je to za normálních okolností plně aktivní enzym schopný rozkladu glykogenu. Enzym defosforylovaný se označuje jako fosforyláza b.[1]
Na molekulu glykogenfosforylázy se však váže celá řada dalších molekul: pro katalytickou aktivitu je zásadní hlavně pyridoxal-5-fosfát (vitamín B6), inhibují ji ATP, glukóza-6-fosfát a glukóza a aktivuje ji AMP.[1]
Mechanismus
Glykogenfosfororyláza štěpí glukózové podjednotky od neredukujících konců glykogenové molekuly.[1]
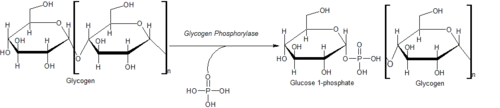
Regulace
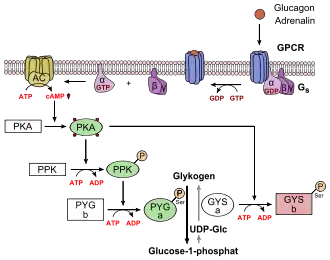
Glykogenfosforyláza je pod přísnou kontrolou celé řady mechanismů, které zpravidla ovlivňují přechod mezi fosforylázou b a fosforylázou a, případně přechod mezi R a T stavy enzymů. Přechod R/T způsobuje vazba různých alosterických regulátorů, uvedených výše - aktivátory navozují R stav, inhibitory T stav.
Přechod mezi fosforylázami „b“ a „a“, který je zpravidla za normálního stavu v buňkách důležitější, způsobuje fosforylace enzymu na pozici Ser14. Fosforylaci katalyzuje fosforyláza-kináza (kináza fosforylázy), zpětnou reakci katalyzuje fosfoproteinfosfatáza I. Existují však i vyšší úrovně regulace glykogenfosforylázy. Např. fosforyláza-kináza je aktivní pouze tehdy, je-li sama fosforylována. Tuto fosforylaci způsobuje cAMP-dependentní proteinkináza (tzv. proteinkináza A). Naopak fosfoproteinfosfatázu I inhibuje tzv. inhibitor fosfoproteinfosfatázy. Tento inhibitor je dále sám pod kontrolou dalších enzymů - aktivuje ho cAMP-dependentní proteinkináza, inhibuje ho fosfoproteinfosfatáza I. Je tedy zřejmé, že regulace aktivity glykogenfosforylázy je velmi komplexní. Navíc je známo, že je úzce provázána s glykogensyntázou, tedy enzymem s opačnou rolí (vytvářet glykogen) – zhruba platí, že je-li glykogenfosforyláza aktivována, glykogensyntáza zůstává „vypnutá“.[1]
Na nejvyšší úrovni je glykogenfosforyláza regulována převážně hladinou cAMP, která následně spouští nebo nespouští proteinkinázu A. cAMP se zvyšuje díky aktivaci adenylátcyklázy, a to například působením hormonů glukagonu či adrenalinu. Při nízkých hladinách glukózy v krvi je možné tímto způsobem rozkládat jaterní glykogen a vzniklý glukóza-6-fosfát přeměňovat pomocí glukóza-6-fosfatázy na glukózu, který odchází do krve.[1]
Onemocnění
Nějakým způsobem nefunkční svalová glykogenfosforyláza může způsobovat McArdleovu chorobu, zatímco mutovaná jaterní fosforyláza má na svědomí Hersovu chorobu.[2]