Erythritol tetranitrát
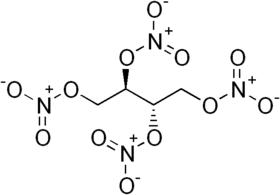
Erythritol tetranitrát (zkratkou ETN)[1] je esterem polyolu eryhtritolu a kyseliny dusičné, sumárním vzorcem C4H6N4O12. Jedná se o bílou látku, která se vyskytuje buď ve formě krystalického prášku, litých bloků nebo kapaliny (nad 61 °C). Je významný svojí výbušností a středně velkou toxicitou. Pod názvem nitroglyn byl používán jako vasodilatátor. Dnes má primární využití v amatérsky připravovaných rozbuškách, sypkých, litých a plastických trhavinách. Jde o látku s velmi podobnou citlivostí, stabilitou a výbušnou silou jakou má pentrit. Na rozdíl od něj se dá prakticky tavit za použití horké vody a odlévat, pro svoji nepatrně vyšší cenu a nepatrně nižší stabilitu oproti pentritu nemá průmyslové uplatnění. ETN je velmi málo rozpustný ve vodě, dobře rozpustný v acetonu a dobře rozpustný v horkém methanolu a ethanolu. Při vylití horkého roztoku ETN v ethanolu do velkého množství vody krystalizuje ETN ve formě malých krystalických plátků (srovnatelně měkkých jako mýdlové vločky) se sypnou hustotou kolem 0,3 g/cm3, tyto lze jemně stlačit na 0,5 g/cm3, ručně lze prášek za použití větší síly stlačit až k přibližně k 1,2 g/cm3. Jemné re-krystalizované krystaly lze připravit převrácením procesu, tedy pomalým kapáním vody do roztoku ETN/ethanolu a důkladným mícháním – ještě jemnější krystaly lze získat šokovým ochlazením nasyceného roztoku ethanolu s ETN z 55 °C na teplotu pod −10 °C v chladicí lázni.. Pružné silikonové formy jsou pro odlévání ideální, vzhledem k jejich snadnému oddělení od ztuhlého ETN, nejvyšší hustoty se dosahuje pomalým chlazením taveného ETN (desítky minut až hodina), rychlé chlazení vede k lehce nižší hustotě litého ETN. Někdy lze při odlévání pozorovat mírný rozklad ETN, signalizovaný lehčím žloutnutím.
| Erythritol tetranitrát | |
|---|---|
 | |
| Obecné | |
| Systematický název | |
| Sumární vzorec | C₄H₆N₄O₁₂ |
| Identifikace | |
| Registrační číslo CAS | 7297-25-8 |
| Vlastnosti | |
| Molární hmotnost | 301,998 Da |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
ETN má citlivost k nárazu kolem 3,28 J (prášek) a 3,79 J (lité), na stejném aparátu má pentrit citlivost 3,93 J (citlivost roztaveného – tedy kapalného ETN je ale velmi vysoká – srovnatelná s třaskavinami jako je TATP a proto se s ním nesmí v roztavené formě riskovat nárazy či pády). Citlivost ke tření je 38,9 N u prášku a 47,7 J u lité směsi. Pentrit má 75,1 J na stejném přístroji.
ETN je schopno silné exploze i při zahřívání malých množství. 20 mg ETN volně položeného na alobalu a zahřáto zespodu plamenem může silně explodovat.
Detonační rychlost lehce stlačeného prášku při hustotě 0,86 g/cm3 je 4800 m/s a u litého ETN je při 1,70 g/cm3 8 030 m/s. Detonační tlak litého ETN se tak pohybuje v blízkosti 300 kbar a brizancí značně předčí slabší vojenské plastické trhaviny jako je např. Semtex (detonační tlak kolem 225 kbar, lité TNT kolem 190).[2] V Hessově zkoušce dává lité ETN nad 26 mm, Semtex ve stejné zkoušce 21 mm. Lité ETN a jeho směsi s hexogenem/pentritem[nedostupný zdroj] jsou nejvíce brizantní výbušninou, kterou lze jednoduše amatérsky připravit. Takové směsi mohou mít detonační tlak Pcj okolo 320 kbar. Lité směsi s MHN mají vypočítaný Pcj kolem 330 kbar, jejich příprava je ale lehce složitější (u MHN nelze jednoduše provést plnou nitraci do šestého stupně a tak jsou lité náložky v praxi slabší než ty s RDX).[3] Nejsilnější vojenské výbušniny na bázi oktogenu mají Pcj 350–370 kbar.
ETN má kladnou kyslíkovou bilanci, protože na dokonalé spálení paliva v molekule stačí 11 atomů (molů) kyslíku a molekula si jich nese rovných 12. Přibližně lze tedy tvrdit, že detonace každého kilogramu ETN uvolní 55 g volného kyslíku (exploze nemusí nutně přesně sledovat naivní stechiometrii). ETN má tedy kyslíkovou bilanci + 5,5 %. K dosažení nulové kyslíkové bilance by bylo nutno přidat k ETN kolem 1,3 % oleje nebo kolem 4 % práškového hliníku (směsi s práškovým hliníkem mají jasnější záblesk). Pro dosažení tříštivého účinku je mnohem vhodnější využít lehce kladné kyslíkové bilance ve výše zmíněných litých směsích s pentritem nebo hexogenem, které naopak mají lehce až středně zápornou kyslíkovou bilanci.
Těžiště současného použití je v amatérských dvojsložkových rozbuškách, kde se obvykle používá náplně 1 g lehce slisovaného ETN a toto je iniciováno několika stovkami miligramů třaskaviny (SADS, dextrinovaný azid olovnatý, HMTD, TACP apod.), případně v rozbuškách typu NPED, kde je uvnitř pevné dutinky uzavřeno několik gramů ETN bez třaskaviny. V provedení NPED se pak odděluje ETN přepážkou z kovové fólie od pyrotechnické směsi, která ETN zahřátím skrze fólii přiměje k detonaci.
ETN se připravuje esterifikací erythritolu. K tomu se používá buď směs 68% kyseliny dusičné a koncentrované kyseliny sírové nebo směs koncentrované kyseliny dusičné a sírové. Další metodou je použití samotné koncentrované kyseliny dusičné nebo směsi dusičnanu amonného (nebo draselného) a kyseliny sírové. Použití směsi konc. kyseliny dusičné a sírové, popř. samotné konc. kyseliny dusičné dává nejlepší výtěžky. Při použití 68% kyseliny dusičné nebo směsi dusičnanů a kyseliny sírové je výtěžnost nižší, obvykle kolem 30–40 % (vzácněji mohou být ale i přes 95 %). Například nitrace 20 g erythritolu směsí 60 g dusičnanu ammonného a 110 ml 96 % kyseliny sírové tak poskytne 20–45 g ETN po rekrystalizaci (alternativní postup je 110 ml kyseliny sírové 96%, 80 g dusičnanu amonného a 20 g erythritolu s výtěžkem 20–45 g ETN). 540 ml 96 % kyseliny sírové, 360 ml 68 % kyseliny dusičné a 150 g erythritolu poskytne až 300 g ETN. Nejméně vhodná je směs dusičnanu draselného a kyseliny sírové, protože vzniká hustá směs, kterou je složité míchat (výtěžnost běžně kolem 30 %). V každém případě musí být erythritol co nejjemnější prášek. Erythritol i případně použité dusičnany musí být rovněž velmi jemně práškové a velmi dobře vysušené. Existují i více exotické techniky – např. použití směsi dusičnanu barnatého a kyseliny sírové. Vzniklá směs špatně rozpustného síranu barnatého a kyseliny dusičné/sírové je pak zfiltrována na vakuu – filtrát pak obsahuje nitrační směs – směs kyseliny dusičné a sírové po provedení nitrace s erythritolem vykazuje až 50% výtěžky. V amatérských podmínkách bez digestoří se k nitraci používají skleněné nádobky s inertním plastovým víčkem (teflon), popř. s dírou ve víčku, kterou prochází tyčinka na míchání. Takto se zabraňuje úniku dráždivých par. Nitrace je prováděna za silného chlazení, poslední stupeň nitrace je ale nutno provádět za pokojové/laboratorní teploty po dobu několika desítek minut až čtyř hodin v závislosti na použité metodě. Při přípravě je nutné mít vedle nádobu s alespoň 5 l vody pro případ vyvření směsi – vroucí směs v nádobě se do ni v případě nehody vhodí. Vyvření směsi hrozí při nedokonalém chlazení vlivem rychlého přidávání erythritolu a špatného míchání. Velikou výhodou je, že nižší estery erythritolu (trinitrát, dinitrát, mononitrát) jsou dobře rozpustné ve vodě a nekontaminují tak vzniklý ETN. Vyloučený produkt je zfiltrován, zneutralizován jedlou sodou rozpuštěnou ve vodě, promyt destilovanou vodou a rekrystalizován z ethanolu a nebo methanolu (tzn. že ETN je rozpuštěn v poměru 1:10 v teplém ethanolu – tj. např. 10 g ve 100 ml ethanolu o teplotě 65 °C a tento roztok je vylit do litru chladné vody, vyloučené ETN je po 10–15 minutách odfiltrováno). Rekrystalizace se provádí pro odstranění uvězněných kapiček nitrační směsi uvnitř krystalů ETN, tyto uvězněné kapičky by snižovaly skladovací stabilitu ETN a znemožňovaly by odlévání).
Reference
- Erythritol tetranitrate was first synthesized by British chemist John Stenhouse (1809-1880) in 1849. He extracted the simple sugar erythritol (which he called "erythroglucin") from lichen and then studied its chemistry. See: John Stenhouse (1 January 1849) "Examination of the proximate principles of some of the lichens. Part II," Philosophical Transactions of the Royal Society (London), vol. 139, pages 393-401. Reprinted in German as: John von Stenhouse (1849) "Über die näheren Bestandtheile einige Flechten," Justus Liebigs Annalen der Chemie und Pharmacie, vol. 70, no. 2, pages 218-228. Condensed version (in German): John Stenhouse (12 Sept. 1849) "Über die näheren Bestandtheile einige Flechten," Pharmaceutisches Centralblatt, vol. 20, no. 40, pages 625-628.
- Explosive Properties of Melt Cast Erythritol Tetranitrate (ETN). www.wydawnictwa.ipo.waw.pl [online]. [cit. 21.2.2018]. Dostupné online.
- Three Insensitive Energetic Co-crystals of 1-Nitronaphthalene, with 2,4,6-Trinitrotoluene (TNT), 2,4,6-Trinitrophenol (Picric Acid) and D-Mannitol Hexanitrate (MHN). Central European Journal of Energetic Materials [online]. [cit. 3.3.2018]. Dostupné online.