Dexibuprofen
Dexibuprofen je nesteroidní antiflogistikum (NSAID). Jedná se o pravotočivý (dextro) enantiomer ibuprofenu. Většina ibuprofenových přípravků obsahuje racemickou směs obou izomerů.[1]
| Dexibuprofen | |
|---|---|
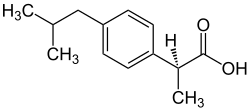 | |
| Název (INN) | Dexibuprofen (angličtina) |
| Název podle IUPAC | (2S)-2-[4-(2-methylpropyl)fenyl]propanová kyselina |
| Kódy | |
| Číslo CAS | 51146-56-6 |
| Klasifikace ATC | M01AE14 |
| ChEMBL ID | CHEMBL175 |
| ChemSpider ID | 36498 |
| PubChem | 39912 |
| Chemie | |
| Sumární vzorec | C₁₃H₁₈O₂ |
| SMILES | CC(C)CC1=CC=C(C=C1)C(C)C(=O)O |
| InChI | InChI=1S/C13H18O2/c1-9(2)8-11-4-6-12(7-5-11)10(3)13(14)15/h4-7,9-10H,8H2,1-3H3,(H,14,15)/t10-/m0/s1 |
| Molární hmotnost | 206,131 Da |
| Některá data mohou pocházet z datové položky. | |
Chemie
Dexibuprofen je v zásadě chirální záměna racemického ibuprofenu. Chirální uhlík v dexibuprofenu je vázán v absolutní konfiguraci (S) podle pravidla Cahn–Ingold–Prelog.[2][3]
Farmakologie
Ibuprofen je kyselina α-arylpropionová rozsáhle využívaná při léčbě revmatoidní artritidy a je široce používán jako léčivo bez předpisu proti bolestem hlavy a dalším druhům mírnějších bolestí. Toto léčivo má chirální centrum a existuje jako dvojice enantiomerů. Za požadovaný léčebný účinek je odpovědný (S)-ibuprofen, eutomer. Zajímavé je, že neaktivní enantiomer (R), distomer, podléhá jednosměrné chirální inverzi na aktivní enantiomer (S); slouží tak jako jeho prolátka.[4][5][6][7] Tedy pokud se ibuprofen podává jako racemát, distomer je in vivo převeden na eutomer, kdežto obrácená přeměna neprobíhá. Chirální inverze může vést k akumulaci jednoho z enantiomerů a k toxicitě. Riziko nežádoucích účinků lze omezit použití čistého enantiomeru (S).[8]
Reference
V tomto článku byl použit překlad textu z článku Dexibuprofen na anglické Wikipedii.
- HARDIKAR, MS. Chiral non-steroidal anti-inflammatory drugs — a review. J Indian Med Assoc.. 2008, roč. 106, čís. 9, s. 615–8, 622, 624. PMID 19552094.
- CAHN, R. S.; INGOLD, Christopher; PRELOG, V. Specification of Molecular Chirality. Angewandte Chemie International Edition in English. 1966, roč. 5, čís. 4, s. 385–415. Dostupné online. ISSN 0014-4754. DOI 10.1007/bf02157171.
- CAHN, R. S.; INGOLD, C.; PRELOG, V. The specification of asymmetric configuration in organic chemistry. Experientia. 1956, roč. 5, čís. 4, s. 81–94. Dostupné online. ISSN 0014-4754. DOI 10.1007/bf02157171.
- Caldwell J, Hutt AJ, Fournel-Gigleux S. The metabolic chiral inversion and dispositional enantioselectivity of the 2-arylpropionic acids and their biological consequences. Biochemical Pharmacology. Leden 1988, roč. 37, čís. 1. DOI 10.1016/0006-2952(88)90762-9. PMID 3276314.
- Hutt AJ, Caldwell J. The metabolic chiral inversion of 2-arylpropionic acids--a novel route with pharmacological consequences. The Journal of Pharmacy and Pharmacology. Listopad 1983, roč. 35, čís. 11, s. 693–704. DOI 10.1111/j.2042-7158.1983.tb02874.x. PMID 6139449.
- Adams SS, Bresloff P, Mason CG. Pharmacological differences between the optical isomers of ibuprofen: evidence for metabolic inversion of the (-)-isomer. The Journal of Pharmacy and Pharmacology. Březen 1976, roč. 28, čís. 3, s. 256–7. DOI 10.1111/j.2042-7158.1976.tb04144.x. PMID 6706.
- Hao H, Wang G, Sun J. Enantioselective pharmacokinetics of ibuprofen and involved mechanisms. Drug Metabolism Reviews. 2005, roč. 37, čís. 1, s. 215–34. DOI 10.1081/dmr-200047999. PMID 15747501.
- SIMONYI, M. On chiral drug action. Medicinal Research Reviews. 1984, roč. 4, čís. 3, s. 359–413. DOI 10.1002/med.2610040304. PMID 6087043.