Depsipeptidy
Depsipeptidy jsou peptidy, které mají alespoň jednu amidovou skupinu (-C(O)NHR-) nahrazenou odpovídajícím esterem (-C(O)OR). Mnoho z nich má v molekulách amidové i esterové vazby. Nejčastěji se objevují v mikroorganismech a mořských organismech.[1]
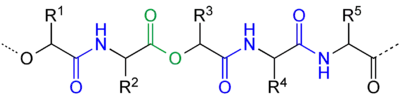
Přírodní depsipeptidy
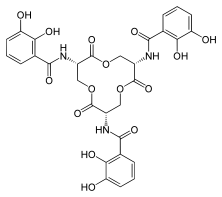
Některé depsipeptidy mají protirakovinné účinky.[3]
Existují také depsipetidy, které inhibují některé enzymy. Patří k nim například romidepsin, látka ze skupiny bicyklických peptidů nazývaných inhibitory histondeacetylázy, která byla poprvé izolována z bakterie Chromobacterium violaceum.[4]
Další depsipeptid etamycin funguje u myší jako léčivo proti meticilin-rezistentnímu zlatému stafylokoku.[5]
Některé depsipeptidy izolované z bakterií Streptomyces mají také antimikrobiální účinky.[6][7] Tyto látky tvoří možnou novou skupinu antibiotik označovanou acyldepsipeptidy. Tato antibiotika aktivují enzymy ze skupiny CLP proteáz, čímž spouštějí neřízený rozklad peptidů a nesložených proteinů, což vede k usmrcení řady grampozitivních bakterií.[8][9][10]
Literatura
- papuamid. Ford PW, Gustafson KR, McKee TC, Shigematsu N, Maurizi LK, Pannell LK, Williams DE, de Silva ED, Lassota P, Allen TM, Van Soest R, Andersen RJ, Boyd MR. Papuamides A-D, HIV-Inhibitory and Cytotoxic Depsipeptides from the Sponges Theonella mirabilis and Theonella swinhoei Collected in Papua New Guinea. J. Am. Chem. Soc. 1999;121:5899–5909
- neamfamid A Oku N, Gustafson KR, Cartner LK, Wilson JA, Shigematsu N, Hess S, Pannell LK, Boyd MR, McMahon JB. Neamphamide A. A new HIV-inhibitory depsipeptide from the Papua New Guinea marine sponge Neamphius huxleyi J. Nat. Prod. 2004; 67(8): 1407-11.
- callipeltin A Zampella A, D'Auria MV, Paloma LG, Casapullo A, Minale L, Debitus C, Henin Y. Callipeltin A, an Anti-HIV Cyclic Depsipeptide from the New Caledonian Lithistida Sponge Callipelta sp. J. Am. Chem. Soc. 1996;118:6202-9
- mirabamidy A-D Plaza A, Gustchina E, Baker HL, Kelly M, Bewley CA. Mirabamides A-D. Depsipeptides from the sponge Siliquariaspongia mirabilis that inhibit HIV-1 fusion J. Nat. Prod. 2007;70(11):1753-60. Andjelic CD, Planelles V, Barrows LR. Characterizing the Anti-HIV Activity of Papuamide A. Mar Drugs. 2008;6(4):528-49
Externí odkazy
 Obrázky, zvuky či videa k tématu Depsipeptidy na Wikimedia Commons
Obrázky, zvuky či videa k tématu Depsipeptidy na Wikimedia Commons
Reference
V tomto článku byl použit překlad textu z článku Depsipeptide na anglické Wikipedii.
- Yasumasa Hamada; Takayuki Shioiri. Recent Progress of the Synthetic Studies of Biologically Active Marine Cyclic Peptides and Depsipeptides. Chemical Reviews. 2005, s. 4441–4482.
- Christopher T. Walsh; Jun Liu; Frank Rusnak; Masahiro Sakaitani. Molecular Studies on Enzymes in Chorismate Metabolism and the Enterobactin Biosynthetic Pathway. Chemical Reviews. 1990, s. 1105–1129.
- J. Kitagaki; G. Shi; S. Miyauchi; S. Murakami; Y. Yang. Cyclic depsipeptides as potential cancer therapeutics. Anticancer Drugs. 2015, s. 59–71.
- Alexander Yurek-George; Alexander Richard Liam Cecil; Alex Hon Kit Mo; Shijun Wen; Helen Rogers; Fay Habens; Satoko Maeda. The First Biologically Active Synthetic Analogues of FK228, the Depsipeptide Histone Deacetylase Inhibitor. Journal of Medicinal Chemistry. 2007, s. 5720–5726. PMID 17958342.
- Nina M. Haste; Varahenage R. Perera; Katherine N. Maloney; Dan N. Tran; Paul Jensen; William Fenical; Victor Nizet. Activity of the streptogramin antibiotic etamycin against methicillin-resistant Staphylococcus aureus. Journal of Antibiotics. 2010, s. 219.
- K. H. Michel, R. E. Kastner (Eli Lilly and Company), US 4492650, 1985 [Chem. Abstr. 1985, 102, 130459]
- Osada, Hiroyuki, Tatsuya Yano, Hiroyuki Koshino, and Kiyoshi Isono. "Enopeptin A, a novel depsipeptide antibiotic with anti-bacteriophage activity." The Journal of Antibiotics 44.12 (1991): 1463-1466.
- Li, Dominic Him Shun, Alba Guarné, Michael R. Maurizi, Yi-Qiang Cheng, Gerard D. Wright, Rodolfo Ghirlando, Ebenezer Joseph, Melanie Gloyd, Yu Seon Chung, and Joaquin Ortega. "Acyldepsipeptide Antibiotics Induce The Formation Of A Structured Axial Channel In ClpP: A Model For The ClpX/ClpA-Bound State Of ClpP." Chemistry & Biology 17.9 (2010): 959-969. Print.
- Hinzen, Berthold, Harald Labischinski, Heike Brötz-Oesterhelt, Rainer Endermann, Jordi Benet-Buchholz, Veronica Hellwig, Dieter Häbich, Andreas Schumacher, Thomas Lampe, Holger Paulsen, and Siegfried Raddatz. "Medicinal Chemistry Optimization of Acyldepsipeptides of the Enopeptin Class Antibiotics." ChemMedChem 1.7 (2006): 689-693. Print.
- Carney, Daniel W., Karl R. Schmitz, Jonathan V. Truong, Robert T. Sauer, and Jason K. Sello. "Restriction of the Conformational Dynamics of the Cyclic Acyldepsipeptide Antibiotics Improves Their Antibacterial Activity." JACS 136 (2014): 1922-1929