Uhličitan amonný
Uhličitan amonný je amonná sůl s chemickým vzorcem (NH4)2CO3, dříve nazývaná „sal volatile“ nebo „sůl z jeleního parohu“ (což je však název spjatý spíše s karbamátem amonným[2]). Uhličitan amonný se používal drcený jako čichací sůl (pro křísení lidí, kteří omdleli). Je znám také jako amonium nebo cukrářské droždí (dnes se pod tímto názvem prodává spíše hydrogenovaná verze této soli, hydrogenuhličitan amonný[3]), což je předchůdce modernějších kypřicích prostředků, jedlé sody (hydrogenuhličitanu sodného) a kypřicího prášku. Pro použití v potravinářství se (společně s hydrogenuhličitanem amonným) označuje jako E503.
| Uhličitan amonný | |
|---|---|
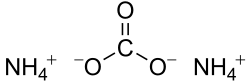
Strukturní vzorec uhličitanu amonného | |
 | |
| Obecné | |
| Systematický název | uhličitan amonný |
| Ostatní názvy | amonium, cukrářské droždí |
| Anglický název | Ammonium carbonate |
| Německý název | Ammoniumcarbonat |
| Sumární vzorec | (NH4)2CO3 |
| Vzhled | bílá krystalická nebo práškovitá látka |
| Identifikace | |
| Registrační číslo CAS | 506-87-6 |
| Vlastnosti | |
| Molární hmotnost | 96,086 g/mol 114,102 g/mol (monohydrát) |
| Teplota rozkladu | 58 °C |
| Hustota | 1,5 g/cm3 |
| Rozpustnost ve vodě | rozpustný, v horké vodě se rozkládá |
| Struktura | |
| Krystalová struktura | krychlová |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −941,9 kJ/mol (monohydrát) |
| Bezpečnost | |
| [1] Varování[1] | |
| R-věty | R22 R36 R37 R38 |
| S-věty | S24/25 |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Výroba
Uhličitan amonný se dříve získával suchou destilací dusíkatých organických materiálů, například vlasů, rohoviny, rozložené moči apod.
Nyní se vyrábí zahříváním směsi chloridu amonného nebo síranu amonného a křídy, do rudého žáru v železných retortech, přičemž páry kondenzují na olověném chladiči. Surový produkt se rafinuje sublimací a výsledkem je bílá vláknitá hmota, která se skládá z hydrogenuhličitanu amonného a uhličitanu amonného v molekulárním poměru; proto se tomuto produktu někdy říká polyuhličitan (polykarbonát) amonný. Má silný zápach po amoniaku a při louhování v alkoholu se uhličitan rozpustí, zatímco hydrogenuhličitan zůstane nerozpuštěný. Podobný proces nastává, je-li směs obou látek vystavena vzduchu.
Plynný amoniak zaváděný do silného vodného roztoku polyuhličitanu ho převádí na normální uhličitan amonný, který lze získat v krystalické podobě z roztoku připravovaného při cca 30 °C. Při expozici vzduchu se amoniak opět uvolňuje a sloučenina přechází zpět na hydrogenuhličitan amonný. Má pH 9.
Použití
Kromě čichacích solí se uhličitan amonný stále používá jako kypřidlo v různých kuchařských receptech, zvláště v severní Evropě a Skandinávii. Někdy je nahrazován kypřicím práškem, ale konečný produkt není nikdy tak vzdušný a lehký jako s původním receptem. Například islandské loftkökur (vzdušné piškoty) jednoduše nelze vyrábět s ničím jiným než s uhličitanem amonným.
Uhličitan amonný se používá také v kanadském Buckleyho kašlacím sirupu, jakožto aktivní složka určená k potlačování příznaků bronchitidy.
Reference
V tomto článku byl použit překlad textu z článku Ammonium carbonate na anglické Wikipedii.
- Ammonium carbonate. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- Vyhláška Ministerstva zemědělství č. 344/2003 Sb., kterou se stanoví požadavky na tabákové výrobky
- Bezpečnostní list - Cukrářské droždí. www.proxim-pu.cz [online]. [cit. 2007-03-30]. Dostupné v archivu pořízeném dne 2007-03-30.
Literatura
- VOHLÍDAL, JIŘÍ; ŠTULÍK, KAREL; JULÁK, ALOIS. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
Související články
- Čichací sůl
- Hydrogenuhličitan amonný
- Kypřidlo
- Kypřicí prášek
Externí odkazy
 Obrázky, zvuky či videa k tématu uhličitan amonný na Wikimedia Commons
Obrázky, zvuky či videa k tématu uhličitan amonný na Wikimedia Commons
