Csk
Csk také C-terminal Src kináza je označení pro tyrosin-kinázu, jejíž substrátem jsou tyrosinové kinázy SFK (Src-family kinase). Funkcí Csk je fosforylace tyrosinových zbytků lokalizovaných na C-konci molekuly kináz rodiny Src (např.: Lck, Hck, Lyn, Fyn, atd.), která má význam při regulačních procesech T i B receptorové signalizace[2].
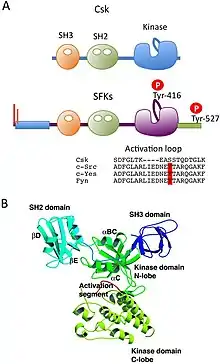
Struktura
Csk je protein o molekulové hmotnosti 56 kDa, jehož strukturu a doménové uspořádání lze částečně připodobnit ke kinázám skupiny SFK. Směrem od N-konce je molekula Csk tvořena tzv. SH2 a SH3 doménami (Src-homology), které zajišťují asociaci s jinými molekulami. Na C-koncové části se nachází doména s vlastní kinázovou aktivitou[3]. Zásadní rozdíl ve struktuře Csk a kináz SFK je absence N-koncové acylace mastnými kyselinami a dále pak absence C-terminálního inhibičního tyrosinu a aktivačního mechanismu autofosforylace[4]. Csk se vyskytuje v buňce ve dvou různých konformacích - ve stavu aktivním či inaktivním a přechod mezi těmito konformacemi je řízeně regulován. V prvním případě je SH2 doména přímo propojena s kinázovou a dochází tak ke stabilizaci aktivní konformace. V inaktivním stavu dochází k rotaci SH2 domény a přerušení linkeru kinázové domény[5].
Regulace aktivity
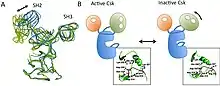
Vzhledem ke skutečnosti, že Csk je volně distribuovaná v cytosolu a její substráty (SFK) ukotveny v buněčné membráně, je zásadním regulačním mechanismem translokace Csk k membráně. Okupace SH2 domény Csk znamená preferenční zaujetí aktivní konformace. Uplatňují se zde scaffold proteiny jako paxillin, caveolin-1[6], Dab2[7], atd. Významné jsou také interakce SH2 domény s jinými fosfoproteiny, jako např. Cbp/PAG1, který kolokalizuje s SFK v rámci lipidových raftů[8]. Důležitý je mechanismus zpětné vazby, předcházející nadměrné aktivaci SFK, která by vedla mj. k nadměrné proliferaci a nekontrolovatelné signalizaci[9].
Mutantní fenotyp
Homozygotní myší mutant s delecí v genu Csk je embryonálně letální a nedochází u něj k uzavření neurální trubice[10]. Csk-deficientní buněčné linie pak vykazují nadměrnou aktivaci SFK a excesivní fosforylaci signálních proteinů. Dochází k celkovému narušení vývoje T-lymfocytů[11]. Podobný efekt má substituce klíčových tyrosinů např. Y184F, která rovněž zabraňuje fosforylaci a tedy inhibici SFK[12].
Reference
- Regulation of the Src Family Kinases by Csk. www.ijbs.com [online]. [cit. 2021-02-13]. Dostupné online. (anglicky)
- OKADA, Masato. Regulation of the Src Family Kinases by Csk. International Journal of Biological Sciences. 2012-11-01, roč. 8, čís. 10, s. 1385–1397. PMID 23139636 PMCID: PMC3492796. Dostupné online [cit. 2021-02-13]. ISSN 1449-2288. DOI 10.7150/ijbs.5141. PMID 23139636.
- NADA, Shigeyuki; OKADA, Masato; MACAULEY, Alasdair. Cloning of a complementary DNA for a protein-tyrosine kinase that specifically phosphorylates a negative regulatory site of p60c-src. Nature. 1991-05, roč. 351, čís. 6321, s. 69–72. Dostupné online [cit. 2021-02-13]. ISSN 0028-0836. DOI 10.1038/351069a0.
- OGAWA, A.; TAKAYAMA, Y.; NAGATA, A. Crystal structure analysis of full-length carboxyl-terminal Src kinase at 2.5 A resolution. dx.doi.org [online]. 2002-03-20 [cit. 2021-02-13]. Dostupné online.
- WONG, Lilly; LIESER, Scot A.; MIYASHITA, Osamu. Coupled Motions in the SH2 and Kinase Domains of Csk Control Src Phosphorylation. Journal of Molecular Biology. 2005-08, roč. 351, čís. 1, s. 131–143. Dostupné online [cit. 2021-02-13]. ISSN 0022-2836. DOI 10.1016/j.jmb.2005.05.042.
- CAO, Haiming; COURCHESNE, William E.; MASTICK, Cynthia Corley. A Phosphotyrosine-dependent Protein Interaction Screen Reveals a Role for Phosphorylation of Caveolin-1 on Tyrosine 14. Journal of Biological Chemistry. 2002-03, roč. 277, čís. 11, s. 8771–8774. Dostupné online [cit. 2021-02-13]. ISSN 0021-9258. DOI 10.1074/jbc.c100661200.
- ZHOU, Jian; SCHOLES, Jessica; HSIEH, Jer-Tsong. Characterization of a Novel Negative Regulator (DOC-2/DAB2) of c-Src in Normal Prostatic Epithelium and Cancer. Journal of Biological Chemistry. 2003-02, roč. 278, čís. 9, s. 6936–6941. Dostupné online [cit. 2021-02-13]. ISSN 0021-9258. DOI 10.1074/jbc.m210628200.
- KAWABUCHI, Masahiro; SATOMI, Yoshinori; TAKAO, Toshifumi. Transmembrane phosphoprotein Cbp regulates the activities of Src-family tyrosine kinases. Nature. 2000-04, roč. 404, čís. 6781, s. 999–1003. Dostupné online [cit. 2021-02-13]. ISSN 0028-0836. DOI 10.1038/35010121.
- ONEYAMA, Chitose; HIKITA, Tomoya; ENYA, Kengo. The Lipid Raft-Anchored Adaptor Protein Cbp Controls the Oncogenic Potential of c-Src. Molecular Cell. 2008-05, roč. 30, čís. 4, s. 426–436. Dostupné online [cit. 2021-02-13]. ISSN 1097-2765. DOI 10.1016/j.molcel.2008.03.026.
- IMAMOTO, Akira; SORIANO, Philippe. Disruption of the csk gene, encoding a negative regulator of Src family tyrosine kinases, leads to neural tube defects and embryonic lethality in mice. Cell. 1993-06, roč. 73, čís. 6, s. 1117–1124. Dostupné online [cit. 2021-02-13]. ISSN 0092-8674. DOI 10.1016/0092-8674(93)90641-3.
- SCHMEDT, Christian; SAIJO, Kaoru; NIIDOME, Tetsuhiro. Csk controls antigen receptor-mediated development and selection of T-lineage cells. Nature. 1998-08, roč. 394, čís. 6696, s. 901–904. Dostupné online [cit. 2021-02-13]. ISSN 0028-0836. DOI 10.1038/29802.
- JOUKOV, Vladimir; VIHINEN, Mauno; VAINIKKA, Satu. Identification of Csk tyrosine phosphorylation sites and a tyrosine residue important for kinase domain structure. Biochemical Journal. 1997-03-15, roč. 322, čís. 3, s. 927–935. Dostupné online [cit. 2021-02-13]. ISSN 0264-6021. DOI 10.1042/bj3220927. (anglicky)