Chelatometrie
Chelatometrie (neboli komplexometrie) je chemická reakce řadící se mezi komplexotvorné titrace. Princip spočívá v tvorbě málo disociovaných komplexů kationtů kovů s aminopolykarboxylovými kyselinami jako je chelaton 1, chelaton 2, chelaton 4. Nejvýznamnější místo pro analytické účely zaujímá disodná sůl ethylendiamintetraoctové kyseliny (EDTA). Ta je dostupná ve formě dihydrátu pod komerčním názvem chelaton 3.[1]

Jedna molekula EDTA (tzv. komplexon 3, v rovnicích označena jako „Y“) reaguje vždy jen s jedním iontem kovu (v rovnicích obecně značen „M“) bez ohledu na jeho mocenství, ve smyslu rovnic:
- M2+ + H4Y → MH2Y + 2 H+
- M3+ + H4Y → MHY + 3 H+
- M4+ + H4Y → MY + 4 H+
Protože se při reakcích kationtů s chelatonem uvolňují protony a protože stálost komplexů chelatonu s ionty závisí na kyselosti (pH), je třeba tyto reakce, tyto titrace, provádět při určitém pH roztoku. pH udržujeme na určité hodnotě pomocí tlumivých roztoků (tzv. pufrů).[2]
Odměrná činidla
Jako odměrné činidlo se v chelatometrii používá roztok chelatonu 3, nejčastěji o molární koncentraci 0,01 – 0,05 mol·dm−3. Vzhledem k tomu, že chelaton nemá vlastnosti základní látky (nemá úplně přesně definované chemické složení, aby se podle navážky dal připravit odměrný roztok o přesné koncentraci, hlavní problém je ne úplně přesný obsah vody), stanovuje se jeho přesná koncentrace standardizací na primární standardy, kterými mohou být čisté kovy (Bi, Zn, Cu) po rozpuštění nebo jejich soli definovaného složení (např.: Bi(NO3)3, PbCl2).[1]
Indikátory
Chemické látky reagující změnou svojí barvy na změnu složení titrovaného roztoku v blízkosti bodu ekvivalence lze vizuálně rozlišit 10 % jedné barvy vedle druhé.[3]
Bod ekvivalence lze indikovat pomocí kovových iontů. Kovové indikátory lze rozdělit na:
- jednobarevné – thiokyanatan či kyselina sulfosalicylová
- metalochromní – obvykle slabé organické vícesytné kyseliny, jejichž anionty jsou dle pH, různě zbarvené, např. eriochromová čerň T, murexid, pyrokatechinová violeť, xylenolová oranž
Při volbě indikátoru je třeba, aby stabilita komplexu kovu s chelatonem byla větší než stabilita komplexu indikátoru s kovem a aby barva komplexu kovu s indikátorem byla jiná než zbarvení volného indikátoru při pH, při kterém byla prováděna titrace.[1]
Průběh protolýzy
Na začátku titrace vytvoří např. anion indikátoru s malým množstvím iontu kovu indikátorový komplex určitého zbarvení.
- Mx+ + Hn−iIndi− → MHn−iIndx−i
Při titraci začne nejdříve reagovat volný kovový ion s chelatonem dle:
- Mx+ H2Y2− → 2H+ + MYx−4
V průběhu titrace koncentrace volného kovu klesá, v těsné blízkosti bodu ekvivalence se uvolní poslední část iontu kovu, od začátku titrace vázaná indikátorem do indikátorového komplexu a proběhne vytěsňovací reakce:
- MHn−iIndx−i + H2Y2− → MYx−4 + Hn−iIndi− + 2 H+
doprovázená změnou zbarvení (vymizí zbarvení příslušného komplexu kovu s indikátorem a objeví se zabarvení příslušející indikátoru).[1]
Přímá titrace
Lze v chelatometrii použít ke stanovení iontů kovů, které reagují s chelatonem za tvorby stabilních komplexů a rychle. Díky rozdílné stabilitě komplexů iontů kovů s chelatonem při různém pH lze vedle sebe stanovovat také přímou titrací 2 různé kovy. Např. směs Bi3+ a Pb2+ lze dohromady ztitrovat v neutrálním, či mírně kyselém pH, ale při nízkém pH, které se získá přidáním silné kyseliny, je stabilní pouze komplex Bi3+ s chelatonem. Nebo je také možnost stanovit vedle sebe Ca2+ a Mg2+ a v tomto případě lze ionty spolu ztitrovat v neutrálním a mírně bazickém pH, ale při vyšším pH se z roztoku vysráží hydroxid hořečnatý Mg(OH)2 a na chelaton se tedy stanoví samotný vápenatý kation. Možnosti ztitrovat vedle sebe nezávisle 2 ionty se říká maskování.
Zpětná titrace
Používá se ke stanovování iontu, ke kterému se při reakci přidá nadbytek odměrného roztoku chelatonu 3 a jeho nezreagované množství se retitruje odměrným roztokem soli kovu (Zn2+, Pb2+, atd.), pro který je k dispozici citlivý indikátor. Zpětné titrace se používá v případě, že tvorba komplexu probíhá zvolna, při analýze málo rozpustných látek ve vodě (CaC2O4, PbSO4, NH4MgPO4,…), ale rozpustných v nadbytku chelatonu 3.
Vytěsňovací titrace
K roztoku stanovovaného kovu se přidá nadbytek méně stabilního chelatonátu hořečnatého či zinečnatého a stanovovaný ion kovu z něj vytěsní stejné látkové množství hořečnatých iontů, jako bylo ve vzorku stanovovaného kovu. Uvolněné hořečnaté či zinečnaté ionty se pak stanoví titrací odměrným roztokem chelatonu 3 na běžný indikátor. Vytěsňovací titrace se používají např. ke stanovení iontů kovů, pro které chybí vhodný indikátor.[1]
Merkurimetrie
Merkurimetrická titrace je založena na tvorbě dobře rozpustných, ale prakticky nedisociovaných sloučenin, které vznikají reakcí disociované dvojmocné rtuťnaté soli (dusičnanu, chloristanu) s komplexotvorným aniontem.
- Hg2+ + 2X− → HgX2
Oblast kvantitativního vzniku komplexu je charakterizována náhlým vzrůstem koncentrace rtuťnatých iontů.
Vizuální indikátory
- nitroprusid sodný – poskytuje v kyselém roztoku opalescenci nitroprusidu rtuťnatého
- difenylkarbazid – intenzivně fialově modré zbarvení.
Jako odměrné činidlo používáme dusičnan rtuťnatý nebo chloristan rtuťnatý. Přesná koncentrace odměrných činidel dusičnanu i chloristanu rtuťného se zjistí standardizací na NaCl jako základní látky.[4]
Obrázky
 Chelaton 4
Chelaton 4
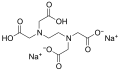 Strukturní vzorec chelatonu 3
Strukturní vzorec chelatonu 3
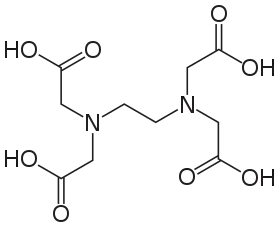 Strukturní vzorec chelatonu 2
Strukturní vzorec chelatonu 2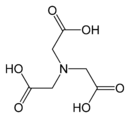 Strukturní vzorec chelatonu 1
Strukturní vzorec chelatonu 1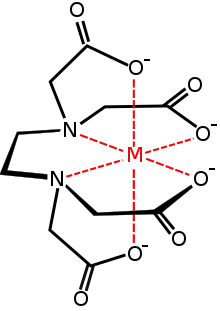 Ion kovu komplexovaný EDTA
Ion kovu komplexovaný EDTA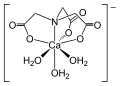 Ion vápníku komplexovaný chelatonem 1
Ion vápníku komplexovaný chelatonem 1
Odkazy
Reference
- JANČÁŘOVÁ, Irena; JANČÁŘ, Luděk. Analytická chemie. Brno: Mendelova zemědělská a lesnická univerzita v Brně, 2003. 196 s. ISBN 978-80-7157-647-1. Kapitola 3.
- Dostupné online.
- Dostupné online.
- Archivovaná kopie [online]. [cit. 2013-05-14]. Dostupné v archivu pořízeném dne 2016-03-06.
Literatura
- JANČÁŘOVÁ, Irena; JANČÁŘ, Luděk. Analytická chemie. Brno: Mendelova zemědělská a lesnická univerzita v Brně, 2003. 196 s. ISBN 978-80-7157-647-1. Kapitola 3.
- http://ach.upol.cz/user-files/files/acc-chelatometrie.pdf
- http://web.natur.cuni.cz/~analchem/bosakova/komplexo.pdf
- http://ciselniky.dasta.mzcr.cz/hypertext/200640/hypertext/MZACV.htm Archivováno 6. 3. 2016 na Wayback Machine