C5 konvertáza
C5 konvertasa je enzym, který řadíme do rodiny serinových proteas. Je součástí komplementové kaskády a hraje tedy důležitou roli v přirozené imunitě.
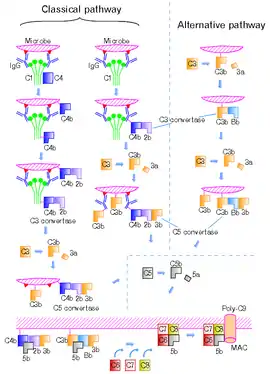

Existují 4 různé C5 konvertasy, které jsou schopné konvertovat sérový glykoprotein C5 na fragmenty C5a a C5b. Dvě z nich fyziologicky patří mezi enzymy komplementu, které asociují s buněčným povrchem a zprostředkovávají klasickou cestu komplementové kaskády (C4bC2aC3b)[1] nebo cestu alternativní (C3bBbC3b).[2][3] Byly popsány dvě konvertasy tekuté fáze – enzym klasické dráhy (C4bC2aoxyC3b) a C5 konvertasa závislá na „faktoru jedu kobry“ (CVFBb).
Struktura
C3 a C5 konvertasy, které se váží k buněčnému povrchu, se liší svým požadavkem na vazbu C3b fragmentu. C3bBb potřebuje pouze 1 molekulu C3b, zatímco alespoň dvě molekuly C3b jsou zapotřebí, aby mohla být vytvořena C5 konvertasa (C3bBbC3b). To znamená, když je C3b na povrchu buňky rozmístěno náhodně, přidáním faktorů B a D se může aktivovat funkce jedině C3 konvertasy. Pokud by bylo na povrchu buňky C3b distribuováno ve shlucích, pak přidáním faktorů B a D můžeme pozorovat aktivitu C3 i C5 konvertasy.[3]
C5 konvertasa klasické cesty se skládá z velkých fragmentů - C4b a C2a, které vznikají štěpením komplementových proteinů (C4 a C2) prostřednictvím komplexu C1, a C3b fragmentu, který vzniká štěpením C3 zprostředkované klasickou C3 konvertasou (C4bC2a).
Skládání alternativní C5 konvertasy (C3bBbC3b) začíná spontánním štěpením C3 proteinu, čímž je odkryta jeho thiolesterová vazba. V přítomnosti patogenu je právě přes tuto vazbu fragment C3b vázán na mikrobiální buněčný povrch. Pokud však infekce neprobíhá, C3b interaguje s molekulami vody, a tím dochází k jeho inaktivaci. Navázaný C3b na buněčný povrch může vázat plazmatický protein faktor B, který je následně štěpen plazmatickou serinovou proteasou faktorem D. Vzniklý komplex C3bBb (= alternativní C3 konvertasa) zůstává asociovaný s buněčným povrchem. Pokud tento komplex interaguje s další molekulou C3b, pak společně vytváří alternativní C5 konvertasu.[4]
CVFBb je nekovalentně asociovaný produkt CVF3 a komplementového fragmentu Bb.
Katalytická podjednotka těchto proteas je C2a či Bb a patří mezi atypické serinové proteasy.[5][6] CVFBb nepotřebuje další molekulu C3, aby mohla štěpit C5, ale C4b2aoxy ano. Modifikovaná C5 konvertasa C4b2aoxyC3b obsahuje C2a, které je odvozeno od oxidovaného C2 proteinu.
Funkce
Cíl působení
Cílem C5 konvertasy je glykoprotein C5, který je tvořen dvěma řetězci (α a β). C5 a C3 proteiny jsou podobné struktury, ale C5 neobsahuje thiolesterovou vazbu, jako je tomu u C3 a C4. Malý počet disulfidických můstků v C5 může částečně vysvětlovat ireverzibilní konformační změny po štěpení C5 na C5a a C5b. Navíc může zodpovídat za nízkou stabilitu proteinu C5, jakmile jej vystavíme chaotropům.[2] Na elektronovém mikroskopu bylo pozorováno, že protein C5 má nepravidelný tvar.[7]
Zaprvé se musí C5 navázat na C3b fragment. Vazebná kapacita pro C3b je stálým znakem komponenty C5, stejně tak fragmnetu C5b. C5 konvertasa selektivně štěpí peptidovou vazbu Arginin-Leucin na α řetězci proteinu C5 v pozici 74-75. Vzniká α´ řetězec o menší molekulové hmotnosti a aktivační peptid C5a. C5a je uvolňováno do okolí, zatímco β řetězec zůstává beze změny.[2]
Komplementová komponenta C5 může být rovněž aktivována C5 konvertasou tekuté fáze. C5 je aktivováno prostřednictvím CVFBb v přítomnosti komplementového proteinu C6. Takto se vytváří komplex C5bC6. Pokud je C6 protein přidán až poté, co je C5 štěpen, nedochází k tvorbě komplexu C5bC6. Pokud C6 zcela chybí, podléhají fragmenty C5b agregaci. Interakce mezi C5 a C6 nebo C5 a membránou jsou nekovalentního charakteru. Proteolytické štěpení proteinu C5 je jediným známým enzymatickým krokem ve formování cytolytického komplexu napadajícího membránu (MAC).[7]
Formace komplexu C5 je závislá na počtu molekul C4, C2 a C3, které jsou přítomné na povrchu buňky. Vazbu C5 ovlivňují proteiny C6 a C7. Na rozdíl od C2, během procesu rozpadu zůstává protein C5 pevně navázaný na buněčném povrchu.[1]
Stabilizace a regulace
Oba enzymy, C4bC2aC3b a C3bBbC3b, jsou nestabilní a podléhají disociaci (poločas rozpadu při 37 °C cca 1,5 – 3 min).[1] Alternativní C5 konvertasa je stabilizována pomocí properdinu (poločas rozpadu při 37 °C cca 10 – 34 min).[2][3] Na druhou stranu C5 konvertasa tekuté fáze (CVFBb) je stabilní (při 37 °C až 7 h).[8] Oxidace proteinu C2 také stabilizuje komplex C4b2aoxy.[9]
Protein příbuzný faktoru H 1 (CFHR1) blokací C5 konvertasy inhibuje komplementovou kaskádu. Ovlivňuje vazbu fragmentů C5b na povrch buňky a tedy i utváření komplexu napadajícího membránu (MAC). Faktor H a CFHR1 v dané posloupnosti kontrolují aktivaci komplementu. U pacientů s hemolyticko-uremickým syndromem (HUS) chybí CFHR1, a v důsledku toho je snížena schopnost inhibovat skládání konečného hemolytického komplexu. Tím pádem jsou vlastní buňky méně chráněné před napadením komplementem.[10]
Reference
V tomto článku byl použit překlad textu z článku C5-convertase na anglické Wikipedii.
- Cooper NR, Müller-Eberhard HJ. THE REACTION MECHANISM OF HUMAN C5 IN IMMUNE HEMOLYSIS. J Exp Med. 1970, s. R775-793. (anglicky)
- DiScipio RG. The activation of the alternative pathway C3 convertase by human plasma kallikrein. Immunology. 1982, s. R587-595. (anglicky)
- Medicus RG, Götze O, Müller-Eberhard HJ. ALTERNATIVE PATHWAY OF COMPLEMENT: RECRUITMENT OF PRECURSOR PROPERDIN BY THE LABILE C3/C5 CONVERTASE AND THE POTENTIATION OF THE PATHWAY. J Exp Med. 1976, s. R1076-1093. (anglicky)
- Abbas AK, Lichtman AH, Pillai S. Cellular and Molecular Immunology.. 6th. vyd. [s.l.]: Elsevier, 2010. Dostupné online. ISBN 978-1-4160-3123-9. (anglicky)
- Kerr MA, Gagnon J. The purification and properties of the second component of guinea-pig complement. Biochem J. 1982, s. R59-67. (anglicky)
- Christie DL, Gagnon J, Porter RR. Partial sequence of human complement component Factor B: Novel type of serine protease. Proc. Natl. Acad. Sci. USA. 1980, s. R4923-4927. (anglicky)
- DiScipio RG, Smith CA, Müller-Eberhard HJ, Hugli TE. The Activation of Human Complement Component C5 by a Fluid Phase C5 Convertase. J Biol Chem. 1983, s. R10629-10636. (anglicky)
- Vogel CW, Müller-Eberhard HJ. The Cobra Venom Factor-dependentC 3 Convertase of Human Complement. J Biol Chem. 1982, s. R8292-8299. (anglicky)
- Polley MJ, Müller-Eberhard HJ. ENHANCEMENT OF THE HEMOLYTIC ACTIVITY OF THE SECOND COMPONENT OF HUMAN COMPLEMENT BY OXIDATION. J Exp Med. 1967, s. R1013-1025. (anglicky)
- Heinen S, Hartmann A, Lauer N et al. Factor H–related protein 1 (CFHR-1) inhibits complement C5 convertase activity and terminal complex formation. Blood. 2009, s. R2439-2447. (anglicky)