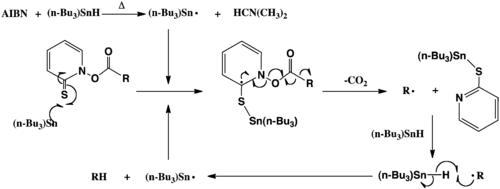Bartonova dekarboxylace
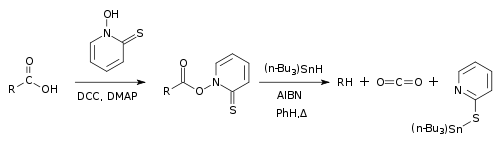
Bartonova dekarboxylace je radikálová organická reakce, při níž se karboxylové kyseliny přeměňují thiohydroxamátové estery (běžně nazývané Bartonovy estery) a produkt je následně zahříván za přítomnosti radikálového iniciátoru a zdroje vodíku za vzniku dekarboxylovaného produktu.[1][2]
Jde o příklad redukční dekarboxylace. Její pomocí lze odštěpit karboxylové skupiny z alkylových skupin a nahradit je jinými.[3][4]
Tuto reakci objevil britský chemik Derek Barton.
Mechanismus
Bartonovu dekarboxylaci zahajuje homolytické štěpení radikálového iniciátoru, tím je zde 2,2'-azobisisobutyronitril (AIBN), které nastává po zahřátí reakční směsi. Následně dojde k odštěpení vodíku z jeho zdroje (tributylcínu) za vzniku tributylstannylového radikálu, který atakuje atom síry v molekule thiohydroxamátového esteru. Vazba N-O thiohydroxamátu je následně homolyticky rozštěpena na karboxylový tradikál, jenž podléhá dekarboxylaci (odštěpení CO2). Zbývající alkylový radikál (R·) pak odštěpí vodík z tributylstannanu a vytvoří redukovaný alkan (RH). Tributylcínový radikál vstoupí do dalšího reakčního cyklu, pokud není thiohydroxamátový ester spotřebován.
Štěpení vazby N-O u Bartonova esteru může také probíhat samovolně po zahřátí nebo ozáření světlem. V tomto případě není potřeba radikálový iniciátor, ovšem nutný stále je donor vodíkových atomů, který vytváří redukovaný alkan. Jako donory vodíku mohou být kromě tributylstannanu použity například terciární thioly či organosilany.[5]
Nákladnosti, zápachu a toxicitě organických sloučenin cínu a křemíku, či thiolů, se lze vyhnout použitím chloroformu jako rozpouštědla i zdroje vodíků.[6]
Také lze provést funkcionalizaci alkylového radikálu použitím látky zachytávající radikály, například (X-Y + R· -> R-X + Y·).[7] Reakci umožňuje tvorba stabilních vazeb S-Sn a zvýšená aromaticita thiohydroxamátového esteru. Při tvorbě plynu, urychlujícího reakci, se také zvyšuje celková entropie.
Odkazy
Související články
- Bartonova–McCombieova deoxygenace
- Hunsdieckerových reakce
- Kochiova reakce
- Krapchova dekarboxylace
- Kolbeova elektrolýza
Externí odkazy
- Bartonova dekarboxylace na organic-chemistry.org
Reference
V tomto článku byl použit překlad textu z článku Barton decarboxylation na anglické Wikipedii.
- D. H. R. Barton; D. Crich; W. B. Motherwell. New and improved methods for the radical decarboxylation of acids. Journal of the Chemical Society, Chemical Communications. 1983, s. 939. DOI 10.1039/C39830000939.
- D. H. R. Barton; D. Crich; W. B. Motherwell. A practical alternative to the hunsdiecker reaction. Tetrahedron Letters. 1983, s. 4979. DOI 10.1016/S0040-4039(01)99826-0.
- D. H. R. Barton; D. Crich; W. B. Motherwell. The invention of new radical chain reactions. Part VIII. Radical chemistry of thiohydroxamic esters; A new method for the generation of carbon radicals from carboxylic acids. Tetrahedron Letters. 1985, s. 3901. DOI 10.1016/S0040-4020(01)97173-X.
- D. H. R. Barton; D. Bridon; S. Z. Zard; I. Fernandaz-Picot. The invention of radical reactions Part XV.1 Some mechanistic aspects of the decarboxylative rearrangement of thiohydroxamic esters. Tetrahedron. 1987, s. 2733. DOI 10.1016/S0040-4020(01)86878-2.
- P. A. Baguley; J. C. Walton. Flight from the Tyranny of Tin: The Quest for Practical Radical Sources Free from Metal Encumbrances. Angewandte Chemie International Edition. 1998-12-04, s. 3072–3082. DOI 10.1002/(SICI)1521-3773(19981204)37:22<3072::AID-ANIE3072>3.0.CO;2-9. PMID 29711327.
- E. J. Ko; G. P. Savage; C. M. Williams; J. Tsanaktsidis. Reducing the Cost, Smell, and Toxicity of the Barton Reductive Decarboxylation: Chloroform as the Hydrogen Atom Source. Organic Letters. 2011-04-15, s. 3072–3082. DOI 10.1021/ol200290m. PMID 21438514.
- M. F. Saraiva; M. R. C. Couri; M. L. Hyaric. The Barton ester free-radical reaction: a brief review of applications. Tetrahedron. 2009, s. 3563. DOI 10.1016/j.tet.2009.01.103.