Argentometrie
Argentometrie, neboli argentometrická titrace je metoda odměrné analýzy (volumetrie) používající AgNO3 jako odměrný roztok. Zjišťuje se pomocí ní např. koncentrace iontů chloru, bromu, jodu nebo kyanidu ve vodě. Titrací roztoku chloridu nebo thiokyanatanu (SCN−) můžeme naopak dokázat přítomnost stříbra. Bod ekvivalence je indikován tehdy, když dalším přídavkem odměrného činidla již nevzniká vizuálně postřehnutelná sraženina, nebo když přidaný indikátor (např. K2CrO4) vytvoří barevnou sloučeninu (hnědočervená v případě Ag2CrO4).
Stanovení dle Mohra
Chloridy kovů IV. (Ba2+, Ca2+, Sr2+, Mg2+) a V. (K+, Na+, Li+) analytické třídy, se přímo titrují v neutrálním prostředí odměrným roztokem AgNO3 na indikátor K2CrO4.
Nejprve se bude stříbrný kation se srážet s chloridem, díky nižšímu součinu rozpustnosti, za vzniku bíle málo rozpustné sraženiny, podle rovnice:
Cl− + Ag+ → AgCl ↓ bílá
Po zreagovaní všech chloridů, se s první nadbytečnou kapkou AgNO3 začnou stříbrné kationty srážet s aniotem indikátoru za vzniku červenohnědé sraženiny, která indikuje bod ekvivalence.
2 Ag+ + CrO42− → Ag2CrO4 ↓ červenohnědá (bod ekvivalence)
Stanovení dle Volharda
K roztoku vzorku chloridů se přidá známý nadbytek odměrného roztoku AgNO3 (rovnice 1). Nereagovaný přebytek roztoku AgNO3 se titruje odměrným roztokem KSCN (rovnice 2) na indikátor Fe(NH4)(SO4)2.12 H2O (kamenec, dodekahydrát bis-síranu amonoželezitého) v prostředí HNO3 do trvale červeného zabarvení (rovnice 3).
Cl− + Ag+ → AgCl ↓ bílá
Ag+ + SCN− → AgSCN ↓ bílá (nadbytek)
6 SCN− + 2 Fe3+ → Fe[Fe(SCN)6] červený roztok (bod ekvivalence)
Obdobně se stanovuje přesná koncentrace odměrného roztoku KSCN (NH4SCN).
Stanovení dle Fajanse
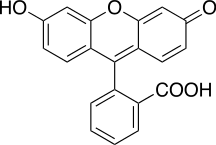
Tímto způsobem lze stanovit všechny halogenidové anionty kromě fluoru. Metoda je založená na adsorpci aniontů indikátoru fluoresceinu na vzniknuvší sraženinu AgX. Když jsou v roztoku přítomny halogenidové anionty v nezanedbatelném množství, adsorbují se na vzniknuvší sraženinu, čímž od ní odpuzují anion fluoresceinu. Po bodě ekvivalence se na sraženinu AgX adsorbují ionty stříbra, které kvůli svému kladnému náboji umožní aniontu fluoresceinu se elektrostaticky navázat na sraženinu.Tím změní roztok v titrační baňce barvu ze svítivě zelené na růžovou.[1] Tuto změnu je možné taky sledovat změnou absorbance, popřípadě poklesem fluorescence.
Reference
- Archivovaná kopie. web.natur.cuni.cz [online]. [cit. 2013-11-03]. Dostupné v archivu pořízeném dne 2015-01-21.