Čičibabinova reakce
Čičibabinova reakce je organická reakce sloužící k přípravě 2-aminopyridinů z pyridinu nebo jeho derivátu reakcí s amidem sodným. Objevil ji Alexej Čičibabin v roce 1914.[1] Obecná rovnice reakce vypadá takto:
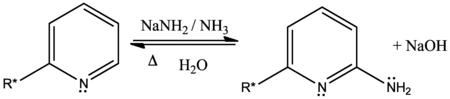
Přímá aminace pyridinu amidem sodným probíhá v kapalném amoniaku. V souladu s mechanismem odpovídajícím adičně-eliminační reakci dochází k nukleofilní adici amidového aniontu NH −
2 a odštěpení hydridového aniontu H−, který je odcházející skupinou.
Byla popsána vnitromolekulární Čičibabinova reakce, v níž je zdrojem dusíku pro aminaci nitrilová skupina v cyklickém řetězci.[2]
Mechanismus
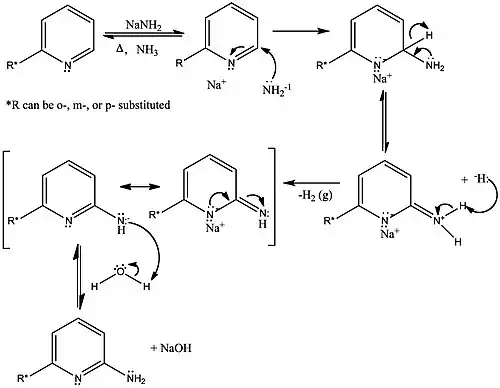
Předpokládá se, že Čičibabinova reakce probíhá adičně-eliminačním mechanismem přes σ-adukt (Meisenheimerův komplex).[3] Nejprve se nukleofilní skupina NH2− naváže na δ+ uhlík a elektrony se přesunou na dusík za vzniku aniontového σ-aduktu, jenž je stabilizován sodnými kationty. Elektrony se následně přesunou z dusíku zpět do cyklu, čímž dojde k obnovení aromaticity. Nakonec záporně nabitá NH skupina přijme proton z vody a vytvoří se konečný produkt.
Průběh reakce lze sledovat pomocí měření tvorby plynného vodíku a červeného zbarvení způsobeného tvorbou σ-aduktu.[3]
Amid sodný je vhodný pro tuto reakci, ovšem obtížně se skladuje.[4]
Vznik σ-aduktu
Ukazuje se, že před adicí aminové skupiny dochází ke spojení heterocyklického dusíku s amidem sodným a tvorbě komplexu se sodným kationtem.[3] Tím dochází k zesílení částečného kladného náboje (δ+) na α uhlíku, což společně s blízkostí aminové skupiny k α uhlíku vede k převaze 1,2-adice nad 1,4-adicí.
Vznik σ-aduktu pravděpodobně probíhá jednoelektronově.[3]
Ve většině případů je σ-adukt nestabilní a jeho tvorba je tedy krokem určujícím rychlost reakce.[3]
Odštěpení hydridového aniontu
Kromě výše uvedeného byly navrženy i jiné mechanismy eliminace hydridového iontu.[3] Možnost eliminace H− následované odštěpením protonu je podporována tím, že nukleofil potřebuje k reakci alespoň jeden proton. V jiném mechanismu dochází k eliminaci hydridového iontu sodíkem za vzniku hydridu sodného.
Vliv různých faktorů na reakci
U některých substrátů trvá Čičibabinova reakce minuty, u jiných hodiny. Rychlost reakce nejvíce ovlivňují tyto faktory:
- Zásaditost reakčního prostředí - vhodné pH pro tuto reakci je 5-8, mimo tento interval probíhá špatně nebo neprobíhá vůbec. V zásaditějším prostředí probíhá rychleji, ovšem pouze do okamžiku, kdy dojde k výraznému nárůstu elektronové hustoty na α uhlíku vedoucímu ke snížení jeho elektrofilicity. Nejsilnější známou zásadou, která může provádět aminaci, je 4-dimethylaminopyridin (pKa 9,37, tedy pKb 4,63).[3]
- Velikost částečného kladného náboje (δ+) na uhlíku - rychlost kineticky řízené aminace záleží na velikosti částečného kladného náboje na uhlíku sousedícím s heterocyklickým dusíkem. U termodynamicky řízených aminací závisí na stabilitě σ-aduktu.[3]
- Snadnost odštěpení hydridového iontu - rychlost Čičibabinovy reakce je také závislá na tom, jak snadno dochází k eliminaci hydridového aniontu a obnovení aromaticity. Jako příklad lze uvést postupný pokles rychlosti reakce u trojice azolů: 1-methylbenzimidazol > 1-methylnaft-[2,3-d]imidazol > 3-methylnaft[1,2-d]imidazol.[3] Jelikož při použití těchto substrátů probíhá adice rychle, tak rozdíly v rychlostech jejich reakcí spočívají převážně v rozdílné schopnosti eliminovat hydridový ion a obnovovat aromatický kruh.[3]
- Substituenty - Skupiny odtahující elektrony Čičibabinovu reakci zpomalují až znemožňují. Možné důvody jsou tři: snížení zásaditosti dusíku a tím zpomalení jeho vazby na amid sodný, tvorba komplexů s amidem sodným, a také (u jednoelektronového mechanismu) změna rozdělení hustoty spinu u v průběhu reakce vznikajícího radikálového aniontu.[3]
Substráty s σ-dimethoxyskupinami se neaminují, protože vytvářejí s amidem sodným stabilní komplexy.[3] Skupiny dodávající elektrony působí deaktivaci a také inhibují Čičibabinovu reakci.
- Benzoanelace - Jelikož je hydridový ion špatnou odcházející skupinou, tak rychlost Čičibabinovy reakce rovněž navyšuje benzoanelace. To se projevuje například nereaktivitou 1-methylimidazolu, zatímco 1-methylbenzimidazol reaguje snadno.[3]
- Rozpouštědlo - Snadnost tvorby polárního aniontového σ-aduktu je závislá na solvatační kapacitě a permitivitě rozpouštědla.[3]
Teplota - V aprotických rozpouštědlech (kde je krokem určujícím rychlost reakce vznik σ-aduktu) reakce probíhá lépe při nižších teplotách, protože při vysokých teplotách dochází k rozkladu.
Vedlejší reakce
Nejčastější vedlejší reakcí bývá dimerizace. Při zahřívání s xylenem a amidem sodným za atmosférického tlaku se 4-terc-butylpyridin z 89 % přeměňuje na svůj dimer, 4,4'-di-terc-butyl-2,2'-bipyridin, a pouze z 11 % na Čičibabinův produkt, kterým je 2-amino-4-terc-butylpyridin.[3] Zvýšením tlaku dusíku na 2,4 MPa se podíl Čičibabinova produktu zvýší na 74 % a dimer bude tvořit pouze 26 % produktu.[3]
Odkazy
Související články
- Aminace
Externí odkazy
 Obrázky, zvuky či videa k tématu Čičibabinova reakce na Wikimedia Commons
Obrázky, zvuky či videa k tématu Čičibabinova reakce na Wikimedia Commons
Reference
V tomto článku byl použit překlad textu z článku Chichibabin reaction na anglické Wikipedii.
- A. E. Chichibabin; O. A. Zeide. New Reaction for Compounds Containing the Pyridine Nucleus. Zhur. Russ. Fiz. Khim. Obshch (J. Russ. Phys. Chem. Soc.). 1914, s. 1216–1236.
- E. Ciganek. Tertiary Carbinamines by Addition of Organocerium Reagents to Nitriles and Ketimines. Journal of Organic Chemistry. 1992, s. 4521–4527. DOI 10.1021/jo00042a037.
- C. McGill; A. Rappa. Advances in the Chichibabin Reaction. Advances in Heterocyclic Chemistry. 1988, s. 1–79. ISBN 9780120206445. DOI 10.1016/s0065-2725(08)60261-5.
- R. N. Shreve; E. H. Riechers; H. Rubenkoenig; A. H. Goodman. Amination in the Heterocyclic Series by Sodium Amide. Industrial and Engineering Chemistry. 1940, s. 173–178. DOI 10.1021/ie50362a008.