Selán
Selán alebo selénovodík je anorganická zlúčenina. Za izbovej teploty ide o plynnú horľavú látku s odporným zápachom, ktorý sa dá zacítiť už aj pri nízkych koncentráciách. Ide o najjednoduchší hydrid selénu a taktiež najtoxickejšiu zlúčeninu selénu.[1]
| Selán | |||||||||||||||||||||||||||||
 Selán | |||||||||||||||||||||||||||||
 Selán | |||||||||||||||||||||||||||||
| Všeobecné vlastnosti | |||||||||||||||||||||||||||||
| Sumárny vzorec | H2Se | ||||||||||||||||||||||||||||
| Synonymá | Selénovodík, kyselina selénovodíková | ||||||||||||||||||||||||||||
| Vzhľad | bezfarebný plyn s odporným zápachom | ||||||||||||||||||||||||||||
| Fyzikálne vlastnosti | |||||||||||||||||||||||||||||
| Molárna hmotnosť | 80,98 g/mol | ||||||||||||||||||||||||||||
| Teplota topenia | −65,73 °C | ||||||||||||||||||||||||||||
| Teplota varu | −41,25 °C | ||||||||||||||||||||||||||||
| Hustota | 3,553 g·dm-3 | ||||||||||||||||||||||||||||
| Rozpustnosť | 0,70 g/100 ml vody taktiež rozpustný aj v sírouhlíku a fosgéne | ||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |||||||||||||||||||||||||||||
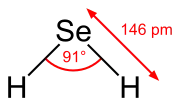
Molekulárna štruktúra a vlastnosti
Molekula selánu má lomený tvar, pričom uhol medzi atómami selénu a vodíku je 91°.
Vlastnosti tejto zlúčeniny sú podobné ako vlastnosti sírovodíku, ale je kyslejší, pričom pKa selénovodíku je 3,89 oproti sírovodíku s pKa 7.
Výroba
Priemyselne sa vyrába reakciou vodíka so selénom pri teplotách vyšších než 300 °C.[2]
V menších množstách v laboratóriu sa zvyčajne pripravuje reakciou vody so selenidom hlinitým, pričom vzniká hydroxid hlinitý a uvoľňuje sa plynný selenovodík[3]:
- Al2Se3 + 6 H2O ⇌ 2 Al(OH)3 + 3 H2Se
Reakcie a využitie
- Reakciou s oxidom siričitým možno zo selenovodíku pripraviť selén, takto pripravený selén je vysoko čistý:
- 2 H2Se + SO2 ⇌ 2 H2O + 2 Se + S
- Taktiež sa využíva na syntézu zlúčenín obsahujúcich selén
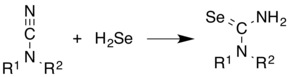
- Príklad vyššie znázorňuje reakciu pri výrobe selenomočoviny z kyanamidu pomocou selénovodíku.[4]
- Pri výrobe polovodičov sa plynný selénovodík používa na ich legovanie selénom.
Toxicita a bezpečnosť
Selénovodík je nebezpečný najmä kvôli svojej toxicite. Dráždivo pôsobí už pri koncentrácii 0,00003% a pri koncentrácii 0,00015% je už neznesiteľný.[5]
Aj napriek jeho silnej toxicite sa u ľudí nezaznamenal prípad otravy touto látkou, pretože pri vdýchnutí má tendenciu rozložiť sa na slizniciach na selén, ktorý je menej toxický než jeho zlúčeniny.[6]
Referencie
- Selenium Compounds EPA (po anglicky, archivované na WaybackMachine)
- Selenium and Selenium Compounds Ullmann's Encyclopedia of Industrial Chemistry (po anglicky)
- Preparation of hydrogen selenide PrepChem (po anglicky)
- A Convenient Synthesis of Mono-, N,N′-Di-, and Trisubstituted Selenoureas from Methyl Carbamimidothioates (S-Methylpseudothioureas) SYNTHESIS (po anglicky)
- Occupational Health Guideline for Hydrogen Selenide CDC (po anglicky)
- Hydrogen selenide (as Se) CDC (po anglicky)



